题目内容
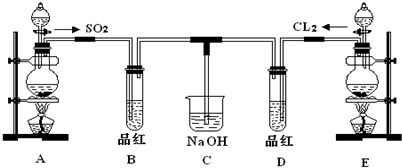
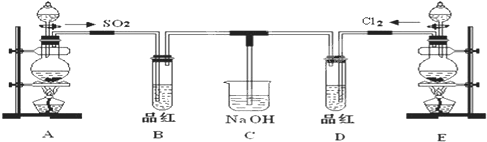
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置.

(1)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B:______,D:______.
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为:
B:______,D:______.
(2)实验中NaOH溶液的作用是:______.
写出Cl2通入NaOH溶液中的化学方程式______.
(1)①氯气和二氧化硫都能是品红溶液褪色,所以B和D装置中品红都褪色,
故答案为:品红褪色;品红褪色;
②二氧化硫漂白后的物质具有不稳定性,加热时又能变为红色,而氯气的漂白具有不可逆性,
所以看到的现象是B中溶液由无色变为红色,D中无明显现象,
故答案为:由无色变为红色;无明显现象;
(2)氯气和二氧化硫都有毒,不能直接排空,氯气和二氧化硫都能和氢氧化钠溶液反应转化为无毒物质,所以氢氧化钠溶液的作用是:吸收多余的二氧化硫和氯气,防止污染大气,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:吸收多余的二氧化硫和氯气,防止污染大气;Cl2+2NaOH=NaCl+NaClO+H2O.
分析:(1)氯气和二氧化硫都能使品红溶液褪色;
(2)氯气和二氧化硫都有毒,不能直接排空,氯气和二氧化硫都能和氢氧化钠溶液反应转化为无毒物质;
氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水.
点评:本题考查了二氧化硫和次氯酸的漂白性,难度不大,注意二氧化硫和次氯酸漂白性的区别,为易错点.
故答案为:品红褪色;品红褪色;
②二氧化硫漂白后的物质具有不稳定性,加热时又能变为红色,而氯气的漂白具有不可逆性,
所以看到的现象是B中溶液由无色变为红色,D中无明显现象,
故答案为:由无色变为红色;无明显现象;
(2)氯气和二氧化硫都有毒,不能直接排空,氯气和二氧化硫都能和氢氧化钠溶液反应转化为无毒物质,所以氢氧化钠溶液的作用是:吸收多余的二氧化硫和氯气,防止污染大气,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:吸收多余的二氧化硫和氯气,防止污染大气;Cl2+2NaOH=NaCl+NaClO+H2O.
分析:(1)氯气和二氧化硫都能使品红溶液褪色;
(2)氯气和二氧化硫都有毒,不能直接排空,氯气和二氧化硫都能和氢氧化钠溶液反应转化为无毒物质;
氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水.
点评:本题考查了二氧化硫和次氯酸的漂白性,难度不大,注意二氧化硫和次氯酸漂白性的区别,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
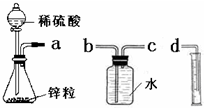 某化学实验小组的同学用下列仪器组装两套完全相同的装置定量探究浓度对反应速率的影响.
某化学实验小组的同学用下列仪器组装两套完全相同的装置定量探究浓度对反应速率的影响.(1)为达到本实验目的其装置连接顺序为:
a连
(2)连接好装置后的下一步操作是
(3)锥形瓶中发生反应的离子方程式为
(4)两套装置的分液漏斗所装的试剂分别为1mol/L硫酸和4mol/L硫酸,该小组同学要测定并记录的数据如下表:
| 加入的试剂 | H2的体积(相同条件下) | 反应时间 | 反应速率 |
| 1mol/L硫酸 | 10mL | t1 | v1 |
| 4mol/L硫酸 | 10mL | t2 | v2 |
(5)另有一组同学测定了每隔一分钟,锥形瓶中硫酸的浓度,记录结果如下:
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 硫酸浓度(mol/L | 4.0 | 3.8 | 3.5 | 3.1 | 2.6 | 2.2 | 1.9 | 1.8 | … |
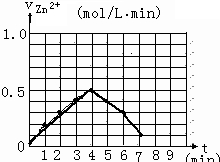
请解释0到4mim时该化学反应速率随时间变化的原因:
(6)除上述实验方案可定量测定该反应的化学反应速率外,还可能有的实验测定方案有: