题目内容
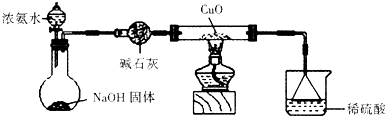
某实验的实验装置如图所示,回答下列有关该实验的问题.(1)该实验所用的石墨棒须经过预处理:先经高温火焰灼烧到红热,再迅速浸入冷水中.这种预处理的目的是 .
(2)要使发光二极管发亮,实验时的操作顺序是 .
(3)断开S1,闭合S2后的各电极的反应式 .

【答案】分析:(1)根据制得的石墨的结构判断;
(2)根据原电池原理分析;
(3)根据原电池原理写出电极反应式;
解答:解:(1)如果石墨棒表面光滑,生成的气体在电极上无法保存,所以不能形成燃料电池,这样处理的石墨表面变得粗糙,且具有吸附性,使生成的气体在石墨棒上保存,为下一步实验作基础.
故答案为:使石墨棒表面变得粗糙,有利于吸附气体.
(2)要使发光二极管发亮,必须有电流通过,当打开S1、关闭S2 时,电极和电解质溶液之间不能形成原电池,所以无电流通过;
关闭S1,该装置形成电解池,电解一段时间后,阴极上有氢气生成,阳极上有氧气生成,且处理过的石墨棒有吸附性,所以两极上存在气体;
打开S1,关闭S2,两电极上分别有氢气、氧气,所以该装置形成燃料原电池,有电流通过二极管,所以二极管发亮.
故答案为:关闭S1,电解一段时间后,打开S1,关闭S2.
(3)打开S1,关闭S2,两电极上分别有氢气、氧气,所以该装置形成燃料原电池,负极上氢气失电子生成氢离子;正极上氧气得电子和水生成氢氧根离子.
故答案为:
正极:O 2+2H2O+4e-=4OH-
负极:2H2-4e-=4H+
点评:本题考查了原电池和电解池原理,解本题的难点是如何形成原电池产生电流使二极管发亮,同时考查学生分析问题、解决问题的能力.
(2)根据原电池原理分析;
(3)根据原电池原理写出电极反应式;
解答:解:(1)如果石墨棒表面光滑,生成的气体在电极上无法保存,所以不能形成燃料电池,这样处理的石墨表面变得粗糙,且具有吸附性,使生成的气体在石墨棒上保存,为下一步实验作基础.
故答案为:使石墨棒表面变得粗糙,有利于吸附气体.
(2)要使发光二极管发亮,必须有电流通过,当打开S1、关闭S2 时,电极和电解质溶液之间不能形成原电池,所以无电流通过;
关闭S1,该装置形成电解池,电解一段时间后,阴极上有氢气生成,阳极上有氧气生成,且处理过的石墨棒有吸附性,所以两极上存在气体;
打开S1,关闭S2,两电极上分别有氢气、氧气,所以该装置形成燃料原电池,有电流通过二极管,所以二极管发亮.
故答案为:关闭S1,电解一段时间后,打开S1,关闭S2.
(3)打开S1,关闭S2,两电极上分别有氢气、氧气,所以该装置形成燃料原电池,负极上氢气失电子生成氢离子;正极上氧气得电子和水生成氢氧根离子.
故答案为:
正极:O 2+2H2O+4e-=4OH-
负极:2H2-4e-=4H+
点评:本题考查了原电池和电解池原理,解本题的难点是如何形成原电池产生电流使二极管发亮,同时考查学生分析问题、解决问题的能力.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
 某实验的实验装置如图所示,回答下列有关该实验的问题.
某实验的实验装置如图所示,回答下列有关该实验的问题.