题目内容
5.A、B、C、D、E在一定条件下存在如下转化关系.其中A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平.E具有水果香味.(部分反应条件、产物被省略).已知:2CH3CHO+O2→2CH3COOH.
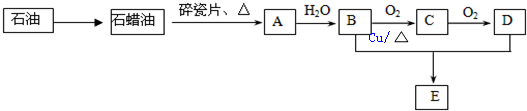
(1)工业上,由石油获得石蜡油的方法是分离;由石蜡油获得A是化学变化.(填“物理”或“化学”)
(2)B、D中所含官能团的名称为羟基、羧基.
(3)写出下列反应方程式,并表明反应类型
A→B:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH;反应类型:加成反应
B→C:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;反应类型:氧化反应
B+D→E:CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;反应类型:酯化反应或取代反应
(4)在实验室制备E物质的过程中,饱和碳酸钠溶液的作用有:中和乙酸、溶解乙醇,降低乙酸乙酯溶解度,便于分层.
(5)在乙酸乙酯、乙醇、乙酸溶液共存的化学平衡体系中加入重水(D2O),经过足够长的时间后,可以发现除水外,体系中含有重氢的化合物是C.
A.乙酸 B.乙醇 C.乙酸、乙醇 D.乙酸乙酯.
分析 A的产量通常衡量一个国家的石油化工水平,则A为CH2=CH2,乙烯与水在一定条件下发生加成反应生成B为CH3CH2OH,乙醇在Cu作催化剂条件下发生氧化反应生成C为CH3CHO,CH3CHO进一步氧化生成D为CH3COOH,CH3CH2OH和CH3COOH在浓硫酸作用下反应酯化反应生成E为CH3COOCH2CH3.
解答 解:A的产量通常衡量一个国家的石油化工水平,则A为CH2=CH2,乙烯与水在一定条件下发生加成反应生成B为CH3CH2OH,乙醇在Cu作催化剂条件下发生氧化反应生成C为CH3CHO,CH3CHO进一步氧化生成D为CH3COOH,CH3CH2OH和CH3COOH在浓硫酸作用下反应酯化反应生成E为CH3COOCH2CH3.
(1)工业上,由石油分馏获得石蜡油,由石蜡油裂化获得乙烯,属于化学变化,
故答案为:分馏;化学;
(2)B为CH3CH2OH,含有官能团为羟基,D为CH3COOH,含有官能团为羧基,
故答案为:羟基;羧基;
(3)A→B是CH2=CH2与水在一定条件下发生加成反应生成CH3CH2OH,反应的化学方程式为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH;
B→C是乙醇在Cu作催化剂条件下发生氧化反应生成CH3CHO,反应的化学方程式为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
反应B+D→E是乙醇与乙酸在浓硫酸、加热条件下生成乙酸乙酯,反应方程式是:CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,也属于取代反应,
故答案为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,加成反应;
2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,氧化反应;
CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,酯化反应或取代反应;
(4)在实验室制备乙酸乙酯的过程中,饱和碳酸钠溶液的作用有:中和乙酸、溶解乙醇,降低乙酸乙酯溶解度,便于分层,
故答案为:中和乙酸、溶解乙醇,降低乙酸乙酯溶解度,便于分层;
(5)酯化反应中羧酸提供羟基,醇提供羟基氢,反应生成酯与水,且是可逆反应,在乙酸乙酯、乙醇、乙酸溶液共存的化学平衡体系中加入重水(D2O),经过足够长的时间后,可以发现除水外,体系中含有重氢的化合物是:乙酸、乙醇,
故答案为:C.
点评 本题考查有机物推断,涉及烯烃、醇、醛、羧酸、酯之间的转化,注意乙酸乙酯之比中饱和碳酸钠溶液作用,酯化反应中羧酸提供羟基、醇提供羟基氢,注意基础知识的理解掌握.

 孟建平名校考卷系列答案
孟建平名校考卷系列答案 在水溶液中存在平衡:
在水溶液中存在平衡: 当
当 与 CH3CH2OH发生酯化反应时,不可能生成的产物是( )
与 CH3CH2OH发生酯化反应时,不可能生成的产物是( )| A. |  | B. |  | C. | H2O | D. | H218O |
| A. | 硝基苯 | B. | 环己烷 | C. | 苯酚 | D. | 溴苯 |
| A. | 氢气的摩尔质量是2克 | |
| B. | 20克氖气所含分子数为0.5NA(NA为阿伏加德罗常数) | |
| C. | 将20克NaOH固体溶于1L水所得溶液的物质的量浓度为0.5mol/L | |
| D. | 在相同温度和压强下,等质量的SO2和SO3所含硫原子个数比为5:4 |
| A. | 常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA | |
| B. | 0.5 mol O3与11.2 L O2所含的分子数一定相等 | |
| C. | 标准状况下,22.4 L的CCl4中含有的CCl4分子数为NA | |
| D. | 常温常压,22.4 L的NO2和CO2混合气体含有2NA个氧原子 |
| A. | 苯中含苯酚杂质:加入溴水,过滤 | |
| B. | 乙烷中含乙烯杂质:通入酸性高锰酸钾溶液,洗气 | |
| C. | 乙醇中含乙酸杂质:加入氢氧化钠溶液洗涤,分液 | |
| D. | 乙酸丁酯中含乙酸杂质:加入饱和碳酸钠溶液洗涤,分液 |

部分含钒物质在水中的溶解性如表:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(1)工业由V2O5冶炼金属钒常用铝热剂法,该反应的氧化剂为3V2O5+10Al $\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3;
(2)滤液中含钒的主要成分为VOSO4(填化学式).
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式NH4++VO3-=NH4VO3↓;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.根据图2判断最佳控制氯化铵系数和温度为4、80℃.
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,反应方程式为:2VO2++H2C2O4+2H+═2VOn++2CO2↑+mH2O,其中n、m分别为2、2.

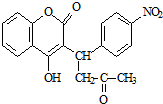 ,醋硝香豆素可以通过以下方法合成(部分反应条件省略).
,醋硝香豆素可以通过以下方法合成(部分反应条件省略).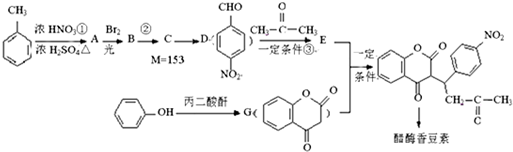
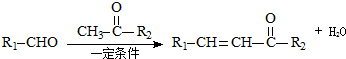
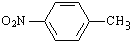 ;反应②的反应类型水解反应或取代反应.
;反应②的反应类型水解反应或取代反应.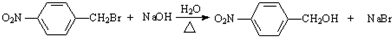 .
.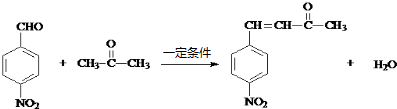 .
.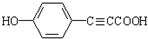 .
.