题目内容
下列反应属于氧化还原反应的是( )
| A、CaO+H2O=Ca(OH)2 | ||||
B、CaCO3
| ||||
C、Fe2O3+3CO
| ||||
D、NH4Cl+NaOH
|
考点:氧化还原反应
专题:
分析:含元素化合价变化的反应,为氧化还原反应,以此来解答.
解答:
解:A、B、D中没有元素的化合价变化,则均为非氧化还原反应,而C中Fe、C元素的化合价变化,只有C为氧化还原反应,
故选C.
故选C.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应判断的考查,题目难度不大.

练习册系列答案
相关题目
下列实验装置不适用于物质分离的是( )
A、 |
B、 |
C、 |
D、 |
C6H14的各种同分异构体中,所含甲基数和它的一氯取代物的数目与下列相等的是( )
| A、2个-CH3,能生成6种一氯代物 |
| B、3个-CH3,能生成4种一氯代物 |
| C、2个-CH3,能生成5种一氯代物 |
| D、4个-CH3,能生成4种一氯代物 |
在一定温度下,A2(g)+B2(g)?2AB(g)达到平衡的标志是( )
| A、单位时间内减少n mol A2,同时生成2n mol AB |
| B、单位时间内生成n mol B2,同时生成n mol AB |
| C、单位时间内生成 2xmol AB,同时生成xmol A2 |
| D、容器内各组成成分的物质的量之和不随时间变化而变化 |
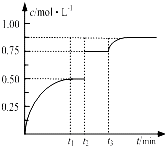 一定温度下,将1molM和1molN气体充入2L恒容密闭容器,发生反应M(g)+N(g)?xP(g)+Q(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体P的浓度随时间变化如图所示.下列说法正确的是( )
一定温度下,将1molM和1molN气体充入2L恒容密闭容器,发生反应M(g)+N(g)?xP(g)+Q(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体P的浓度随时间变化如图所示.下列说法正确的是( )| A、反应方程式中的x=1 |
| B、t2时刻改变的条件是使用催化剂 |
| C、t3时刻改变的条件是移去少量物质Q |
| D、t1~t3间该反应的平衡常数均为4 |
为了说明影响化学反应快慢的因素,甲、乙、丙、丁四位学生分别设计了如下A~D四个实验,你认为结论不正确的是( )
| A、将铜片放入稀硫酸中,无现象.若再向所得的溶液中加入硝酸银溶液,一段时间后,由于形成原电池,可看到有氢气产生 |
| B、在相同条件下,等质量的大理石块和大理石粉与相同的盐酸反应,大理石粉反应快 |
| C、将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解 |
| D、两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 |
化学与生产生活、环境保护、资利用、能开发等密切相关.下列说法错误的是( )
| A、煤炭经气化、液化和干馏等过程,可以转化为清洁能 |
| B、利用二氧化碳制造全降解塑料,可以缓解温室效应 |
| C、利用生物方法脱除生活污水中的氮和磷,防止水体富营养化 |
| D、高纯硅广泛应用于太阳能电池、计算机芯片和光导纤维 |
下列关于氯水的叙述,正确的是( )
| A、新制氯水中只含Cl2和H2O分子 |
| B、新制氯水可使蓝色石蕊试纸先变红后褪色 |
| C、光照氯水有气泡逸出,该气体是Cl2 |
| D、氯水放置数天后酸性下降 |
下列叙述正确的是( )
| A、1 mol H2O的质量为18 g/mol |
| B、CH4的摩尔质量为16 g |
| C、3.01×1023个SO2分子的质量为32 g |
| D、2mol NaOH溶于1 L水中配成溶液的浓度为2 mol?L-1 |