题目内容
将等物质的量的两种氧化物溶于100 ml 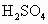 ,而后逐滴加入1.00
mol/L NaOH溶液.当加入的NaOH
,而后逐滴加入1.00
mol/L NaOH溶液.当加入的NaOH 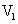 =50
ml时开始有沉淀析出,且沉淀量随NaOH加入量增多而逐渐增加;当NaOH的体积
=50
ml时开始有沉淀析出,且沉淀量随NaOH加入量增多而逐渐增加;当NaOH的体积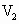 =650
ml时,沉淀量达最大值;继续滴加NaOH时,沉淀量逐渐减小.当
=650
ml时,沉淀量达最大值;继续滴加NaOH时,沉淀量逐渐减小.当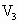 ≥750
ml时,沉淀量不变.
≥750
ml时,沉淀量不变.
(1)最初加入的50 ml NaOH溶液的作用是什么?
(2)计算所用硫酸的浓度.
(3)试判断两种氧化物各是什么,并计算其物质的量.
答案:
解析:
解析:
|
由题分析知其中一种金属氧化物为
又∵金属氧化物是等物质的量,故另一种金属氧化物也为+3价.可推测其为 (1)最初加入NaOH溶液是为了中和多余的硫酸. (2)因为在沉淀最大量时,硫酸均变成了硫酸钠,故 ∴ (3)两种氧化物是 2x·3+2x·3=0.6×1.00 |

练习册系列答案
相关题目
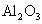 ,则据下图:
,则据下图: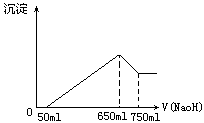
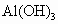 沉淀溶解时用NaOH溶液100mL,故生成
沉淀溶解时用NaOH溶液100mL,故生成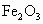 .故
.故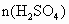 =
=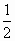 ×0.65×1.00mol=0.325mol
×0.65×1.00mol=0.325mol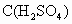 =
=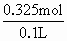 =3.25mol·
=3.25mol·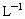
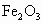 和
和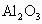 .设其物质的量均为xmol.则
.设其物质的量均为xmol.则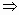 x=0.05mol(据生成沉淀耗NaOH)
x=0.05mol(据生成沉淀耗NaOH)





 Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解
Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解
 NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,Cu与液态N2O4反应制得无水硝酸铜的化学方程式是
NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,Cu与液态N2O4反应制得无水硝酸铜的化学方程式是
