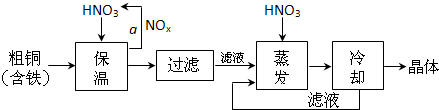
��Ŀ����

���ڲ���a�У���Ҫͨ��������ˮ����Ŀ����
���ڱ���ȥ���Ĺ����У�ΪʹFe3+������ȫ����������Һ�м���CuO��������Һ��pH�����ü�ˮ�ķ���������ҺpH��ԭ����
�۽�������Ũ��ʱ��Ҫ�����������Һ��pH=1����Ŀ���ǣ�������ӷ���ʽ˵����
 Cu��OH��2+2H+���������������������ͭ��ˮ��
Cu��OH��2+2H+���������������������ͭ��ˮ�� Cu��OH��2+2H+���������������������ͭ��ˮ��
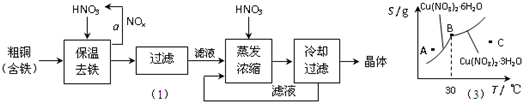
Cu��OH��2+2H+���������������������ͭ��ˮ����2����ͼ��ijС��ͬѧ�������������������ͭ����[Cu��NO3��2?nH2O]���ܽ�����ߣ��¶���30��ǰ���Ӧ��ͬ�ľ��壩������˵����ȷ����

a��A��ʱ����ҺΪ��������Һ
b��B��ʱ���־�����Թ���
c���������������յõ��ľ�����Cu��NO3��2?3H2O
d������C��ʱ����Һ������30�����£���������Cu��NO3��2?6H2O����
��3��ijЩ���ۻ������H2O��NH3��N2O4�ȣ���Һ̬ʱ�����ĵ����ԣ���Ҫ����Ϊ�����˵��룬�磺2NH3
 NH4++NH2-���ɴ��Ʊ���ˮ����ͭ�ķ���֮һ����Cu��Һ̬N2O4��Ӧ��Һ̬N2O4����õ������������������������18��Cu��Һ̬N2O4��Ӧ�Ƶ���ˮ����ͭ�Ļ�ѧ����ʽ��
NH4++NH2-���ɴ��Ʊ���ˮ����ͭ�ķ���֮һ����Cu��Һ̬N2O4��Ӧ��Һ̬N2O4����õ������������������������18��Cu��Һ̬N2O4��Ӧ�Ƶ���ˮ����ͭ�Ļ�ѧ����ʽ����Fe3+��ˮ�⣬Ϊ������Һ������Ũ����Ӧ������Ũ��Һ��
�۴�Ӱ������ˮ��ƽ���ƶ��ĽǶȷ�����
��2���������ߣ����������ϵĵ�Ϊ������Һ״̬�����ݲ�ͬ�¶����þ��岻ͬ������
��3���������غ�ĽǶ���д��Ӧ�Ļ�ѧ����ʽ��
��ͬ��������������֮�ȵ������ʵ���֮�ȣ��ɼٶ�NO2��NO�������Ϊ1mol��O2Ϊ0.6mol���������к���xmolNO2��ymolNO��
����
|
��֮��
|
���Ի��������NO2��NO�����ʵ���֮��Ϊ3��7��
�ʴ�Ϊ�����ԭ�ϵ������ʣ�������Ⱦ����ŷţ�3��7��
��Fe3+��ˮ�⣬Ϊ������Һ������Ũ����Ӧ������Ũ��Һ������ˮ�Ὣ��Һϡ�ͣ������ڽ���Һ����Ũ����
�ʴ�Ϊ����ˮ�Ὣ��Һϡ�ͣ������ڽ���Һ����Ũ����
������ͭ��Һ�д��ڣ�Cu2++2H2O
 Cu��OH��2+2H+����������Ũ��ʱ��Ҫ�����������Һ��pH=1��������������ͭ��ˮ�⣬����������ͭ�����������
Cu��OH��2+2H+����������Ũ��ʱ��Ҫ�����������Һ��pH=1��������������ͭ��ˮ�⣬����������ͭ������������ʴ�Ϊ������Cu2+����ˮ�⣺Cu2++2H2O
 Cu��OH��2+2H+���������������������ͭ��ˮ�⣻
Cu��OH��2+2H+���������������������ͭ��ˮ�⣻��2��a�����������ϵĵ�Ϊ������Һ״̬��A���������Ϸ���ӦΪ��������Һ����a����
b��B��Ϊ���ɾ����ת�۵㣬���־�����Թ��棬��b��ȷ��
c�������������ڵ����½��еģ����յõ��ľ�����Cu��NO3��2?6H2O����c����
d����ͼ����Կ�������Һ������30�����£���������Cu��NO3��2?6H2O���壬��d��ȷ��
�ʴ�Ϊ��b��d��
��3��Cu��Һ̬N2O4��Ӧ�Ƶ���ˮ����ͭ�����������غ�͵����غ��д����Ӧ�Ļ�ѧ����ʽΪCu+2N2O4=Cu��NO3��2+2NO����
�ʴ�Ϊ��Cu+2N2O4=Cu��NO3��2+2NO����

 ��ս100��Ԫ����Ծ�ϵ�д�
��ս100��Ԫ����Ծ�ϵ�д���1����ҵ���Դ�ͭΪԭ�ϲ�ȡ��ͼ��ʾ�����Ʊ�����ͭ���壺
���ڲ���a�У�����Ҫͨ��������ˮ����Ŀ���� ��
���ڱ���ȥ���Ĺ����У�ΪʹFe3+������ȫ����������Һ�м���CuO��������Һ��pH�������±����ݣ���Һ��pHӦ������ ��Χ��
|
| �������↑ʼ����ʱ��pH | �������������ȫʱ��pH |
| Fe3+ Cu2+ | 1.9 4.7 | 3.2 6.7 |
���ü�ˮ�ķ���������ҺpH��ԭ���� ��
�۽�������Ũ��ʱ��Ҫ�����������Һ��pH=1����Ŀ���ǣ�������ӷ���ʽ˵���� ��
��2����ҵ�ϳ���������ͭ��Һ���ͭ�����ʱ�����ĵ缫��Ӧʽ�� ��
��3��ͼ-2��ijС��ͬѧ�������������������ͭ����[ Cu(NO3)2��nH2O ]���ܽ�����ߣ��¶���30��ǰ���Ӧ��ͬ�ľ��壩������˵����ȷ���� ������ĸ����
a. A��ʱ����ҺΪ��������Һ
b. B��ʱ���־�����Թ���
c. �������������յõ��ľ�����Cu(NO3)2��3H2O
d. ����C��ʱ����Һ������30�����£���������Cu(NO3)2��6H2O����
��1����ҵ���Դ�ͭΪԭ�ϲ�ȡ��ͼ��ʾ�����Ʊ�����ͭ���壺
���ڲ���a�У�����Ҫͨ��������ˮ����Ŀ���� .
���ڱ���ȥ���Ĺ����У�ΪʹFe3+������ȫ����������Һ�м���CuO��������Һ��pH�������±����ݣ���Һ��pHӦ������ ��Χ��
|
| �������↑ʼ����ʱ��pH | �������������ȫʱ��pH |
| Fe3+ Cu2+ | 1.9 4.7 | 3.2 6.7 |
���ü�ˮ�ķ���������ҺpH��ԭ���� ��
�۽�������Ũ��ʱ��Ҫ�����������Һ��pH=1����Ŀ���ǣ�������ӷ���ʽ˵���� ��
��2����ҵ�ϳ���������ͭ��Һ���ͭ�����ʱ�����ĵ缫��Ӧʽ�� ��
��3��������ͭ��Һ�У���������Ũ���ɴ�С��˳���� ��
 NH4++NH2-���ɴ��Ʊ���ˮ����ͭ�ķ���֮һ����Cu��Һ̬N2O4��Ӧ��Һ̬N2O4����õ������������������������18����Һ̬N2O4����ķ���ʽ��
NH4++NH2-���ɴ��Ʊ���ˮ����ͭ�ķ���֮һ����Cu��Һ̬N2O4��Ӧ��Һ̬N2O4����õ������������������������18����Һ̬N2O4����ķ���ʽ��