题目内容
【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:
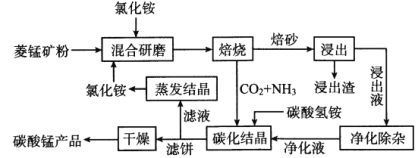
已知:①菱锰矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
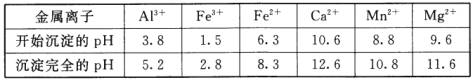
②相关金属离子[c0(Mn+)=0.1mol/L]形成氢氧化物沉淀的pH范围如下:
③常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11。
回答下列问题:
(1)“焙烧”时发生的主要反应的化学方程式为_________。
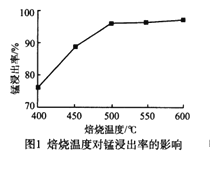
分析下列图1,氯化铵焙烧菱锰矿的最佳条件是:焙烧温度为500℃。分析选择反应温度为500℃的原因_________________。
(2)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为_________;再调节溶液的pH将Al3+、Fe3+变为沉淀除去,溶液pH的范围为_________;然后加入NH4F将Ca2+、Mg2+变为CaF2、MgF2沉淀除去,两种沉淀共存时溶液中![]() =_________。
=_________。
(3)碳化结晶时,反应的离子方程式为_________。
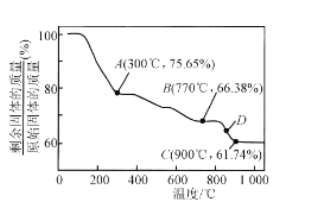
(4)MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示,300℃—770℃范围内,发生反应的化学方程式为________________________。
【答案】MnCO3+2NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O 温度低,速率慢浸出率低;温度过高,浸出率变化不大,成本增加 MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O 5.2≤pH<8.8 1.97 Mn2++2HCO3-
MnCl2+2NH3↑+CO2↑+H2O 温度低,速率慢浸出率低;温度过高,浸出率变化不大,成本增加 MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O 5.2≤pH<8.8 1.97 Mn2++2HCO3-![]() MnCO3+CO2↑+H2O 3MnO2=Mn3O4+O2↑
MnCO3+CO2↑+H2O 3MnO2=Mn3O4+O2↑
【解析】
(1)焙烧时主要的化学反应是碳酸锰和氯化铵在加热条件下生成氯化锰、氨气、二氧化碳、水;500℃之前的浸出率较低,再升高温度,浸出率变化很小;
(2)该反应中,MnO2被还原,Fe2+被氧化,根据氧化还原反应中转移电子守恒以及原子、电荷守恒书写;需除去Al3+、Fe3+的同时,不能除去Mn2+;根据Ksp的关系计算即可;
(3)根据碳酸氢根离子电离出的碳酸根离子生产碳酸锰;
(4)根据加热过程中Mn元素质量不变分析300℃以及770℃时固体成分进行分析。
(1)焙烧过程中发生的主要反应的化学方程式为:MnCO3+2NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O;温度过低,反应速率慢、浸出率低;随着温度的升高,锰浸出率逐渐升高,但在500℃以后,锰浸出率增加缓慢,并且在500℃时,锰浸出率已经达到95%以上,温度过高,浸出率变化不大,成本增加,故焙烧温度取500℃即可;
MnCl2+2NH3↑+CO2↑+H2O;温度过低,反应速率慢、浸出率低;随着温度的升高,锰浸出率逐渐升高,但在500℃以后,锰浸出率增加缓慢,并且在500℃时,锰浸出率已经达到95%以上,温度过高,浸出率变化不大,成本增加,故焙烧温度取500℃即可;
(2)净化除杂中加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;由表可知,Fe3+、Al3+完全沉淀的pH分别为2.8和5.2,Mn2+开始沉淀pH为8.8,故若要将Al3+、Fe3+变为沉淀除去,但Mn2+不能沉淀,故需条件pH的范围为5.2≤pH<8.8;当两种沉淀共存时,溶液中![]() =1.97;
=1.97;
(3)“碳化结晶”时,加入碳酸氢铵时HCO3-的电离促进Mn2+生成MnCO3,同时HCO3-与电离出的H+反应生成水和CO2,发生反应的离子方程式为Mn2++2HCO3-![]() MnCO3+CO2↑+H2O;
MnCO3+CO2↑+H2O;
(4)假设起始n(MnCO3)=1mol,则m(MnCO3)=115g,m(Mn)=55g,加热过程中Mn元素的质量不变,A点时固体质量为115g×75.65%=87g,则m(O)=32g,故![]() ,故A点对应的化学式为MnO2,同理可计算出B点对应的化学式为Mn3O4,故300℃—770℃范围内,发生反应的化学方程式为:3MnO2===Mn3O4+O2↑。
,故A点对应的化学式为MnO2,同理可计算出B点对应的化学式为Mn3O4,故300℃—770℃范围内,发生反应的化学方程式为:3MnO2===Mn3O4+O2↑。

 步步高达标卷系列答案
步步高达标卷系列答案【题目】化合物A、B是中学常见的物质,其阴、阳离子只能从下表中选择。
阳离子 | K+、Na+、Fe2+、Ba2+、NH4+ 、Ca2+ |
阴离子 | OH–、NO3–、I–、HCO3–、AlO2–、HSO4– |
(1)若A、B的水溶液均为无色,且A的水溶液呈强酸性,B的水溶液呈强碱性。混合后产生不溶于稀硝酸的白色沉淀及能使红色石蕊试纸变蓝色的气体。
①B的化学式为________________,生成的气体电子式为___________
②A、B溶液混合加热反应的离子方程式___________________________________。
(2)若A的水溶液呈浅绿色,B的水溶液无色且其焰色反应为黄色。向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合亦无明显变化。
①A的化学式为________________。
②经分析上述过程中溶液变黄的原因可能有两种:I._________________________、Ⅱ.____________________________________________。(用离子方程式表示)
③请用一简易方法证明上述溶液变黄的原因__________________________________ 。




