题目内容
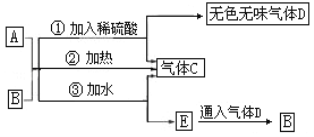
【题目】下图中每一个方框内的字母代表一种反应物或生成物:

已知:气态烃C的密度是同温同压下H2密度的13倍;气态烃F的产量是衡量一个国家化工产业发展水平的重要标志;物质G的相对分子质量是C的3倍,和H反应时产生明亮而带浓烈黑烟的火焰;I常温下是一种能使澄清石灰水变浑浊的无色无味气体。
根据以上描述,回答下列问题:
(1)写出下列物质的结构简式或化学式:A:__________;C:________;F:__________。
(2)完成下列反应的化学方程式:
③C在高温高压催化剂条件下聚合生成G:______________________________________
④G和F在催化剂存在时共热:______________________________________
【答案】CaC2CH≡CHCH2=CH23CH≡CH → ![]()
![]() + CH2=CH2 →
+ CH2=CH2 →![]()
【解析】
气态烃C的密度是同温同压下H2密度的13倍,说明其相对分子质量为26,该物质为乙炔,气态烃F的产量是衡量一个国家化工产业发展水平的重要标志,说明该物质为乙烯;物质G的相对分子质量是C的3倍,则该物质的相对分子质量为78,和H反应时产生明亮而带浓烈黑烟的火焰,说明G为苯,H 为氧气;I常温下是一种能使澄清石灰水变浑浊的无色无味气体,为二氧化碳。结合框图分析,A为碳化钙,B为水,C为乙炔,D为氢氧化钙,E为氢气,F为乙烯,G为苯,H为氧气,J为碳酸钙。
(1)根据以上分析可知,A为碳化钙,分子式为CaC2;C为乙炔,结构简式为CH≡CH;F为乙烯,结构简式为CH2=CH2。(2)③乙炔在高温高压催化剂条件下聚合生成苯,方程式为:3CH≡CH → ![]() ;④苯和乙炔在催化剂存在时共热生成乙苯,方程式为:
;④苯和乙炔在催化剂存在时共热生成乙苯,方程式为:![]() + CH2=CH2 →
+ CH2=CH2 →![]() 。
。

【题目】某实验小组以 H2O2 分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2 溶液 | 无 |
② | 10 mL 5% H2O2 溶液 | 无 |
③ | 10 mL 5% H2O2 溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
④ | 10 mL 5% H2O2 溶液+少量 HCl 溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
⑤ | 10 mL 5% H2O2 溶液+少量 NaOH溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
(1)催化剂能加快化学反应速率的原因是_____。
(2)实验①和②的目的是_________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下 H2O2 稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_____。
(3)写出实验③的化学反应方程式:_____。
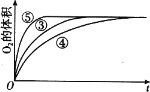
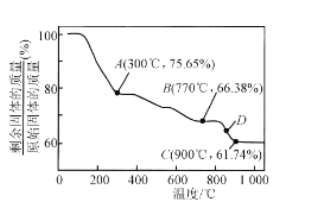
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析如图能够得出的实验结论是_____。