题目内容
在25℃时,100mL 0.4mol/L的硫酸溶液与等体积0.6mol/L的氢氧化钠溶液混合后,溶液的pH等于多少?
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:n(H2SO4)=0.1L×0.4mol/L=0.04mol,则n(H+)=2n(H2SO4)=0.08mol,n(NaOH)=0.1L×0.6mol/L=0.06mol,氢离子过量,根据反应:OH-+H+=H2O,计算过量的c(H+),进而根据pH=-lgc(H+)计算溶液的pH.
解答:
解:n(H2SO4)=0.1L×0.4mol/L=0.04mol,则n(H+)=2n(H2SO4)=0.08mol,n(NaOH)=0.1L×0.6mol/L=0.06mol,氢离子过量,
则反应后:c(H+)=
=0.1mol/L,
pH=-lgc(H+)=1,
答:溶液的pH等于1.
则反应后:c(H+)=
| 0.08mol-0.06mol |
| 2L |
pH=-lgc(H+)=1,
答:溶液的pH等于1.
点评:本题考查酸碱混合后溶液PH的计算,题目难度不大,注意把握相关计算公式即可.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
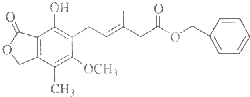 有关如图所示化合物的说法正确的是( )
有关如图所示化合物的说法正确的是( )| A、既可以与Br2的CCl4溶液发生加成反应,不能在光照下与Br2发生取代反应 |
| B、既可以催化加氢,又可以使酸性KMnO4溶液褪色 |
| C、既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 |
| D、1mol该化合物最多可以与4mol NaOH反应 |
根据阿伏加德罗理论:在相同温度和压强下,相同体积的任何气体都含有相同数目的粒子.在一定温度和压强下,1体积的A2气体和3体积的B2气体合成2体积的C气体,则C气体的化学式为( )
| A、AB |
| B、AB3 |
| C、A3B |
| D、A2B3 |
对于反应N2+O2?2NO,在密闭容器中进行,下列条件中能使该反应的逆反应速率加快的是( )
| A、缩小体积使压强增大 |
| B、压强不变充入He使体积增大 |
| C、体积不变充入He使压强增大 |
| D、压强不变充入N2使体积增大 |
三聚氰胺,分子式C3H6N6.是一种用途广泛的基本有机化工中间产品.动物长期摄入三聚氰胺会造成生殖、泌尿系统的损害,膀胱、肾部结石,并可进一步诱发膀胱癌.有毒的三鹿牌奶粉就是因为其牛奶和奶粉中添加三聚氰胺,以提升食品检测中的蛋白质含量指标.下列关于三聚氰胺的说法中你认为正确的是( )
| A、三聚氰胺之所以被不法分子加入奶粉中,就是因为其蛋白质含量较高的原因 |
| B、三聚氰胺的中碳、氢、氮三种元素的质量比为12:1:14 |
| C、每摩尔三聚氰胺分子中含有原子个数为15NA(用NA表示阿伏德罗常数的值) |
| D、三聚氰胺的摩尔质量为126 |


