题目内容
2.下列热化学方程式中△H代表燃烧热(25℃,101kPa)的是( )| A. | CH4(g)+$\frac{3}{2}$O2(g)═2H2O(l)+CO(g)△H1 | B. | 2CO(g)+O2(g)═2CO2(g)△H2 | ||
| C. | S(s)+$\frac{3}{2}$O2(g)═SO3(s)△H3 | D. | C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H4 |
分析 物质的燃烧热,通常在25℃,101 kPa时,1 mol可燃物完全燃烧生成稳定的化合物时所放出的热量,书写燃烧热的热化学方程式时可燃物一定是1 mol,即可燃物的计量系数一定是1,其他物质的计量系数可以用分数,反应中C→CO2,H→H2O(液),S→SO2(气),据此进行解答.
解答 解:A.该反应物中CH4燃烧生成的稳定氧化物应该为CO2,而不是CO,该反应的焓变不代表CH4的燃烧热,故A错误;
B.反应2CO(g)+O2(g)═2CO2(g)△H2中CO的化学计量数不是1,该反应的焓变不代表CO的燃烧热,故B错误;
C.S单质燃烧生成的稳定氧化物为SO2(g),而不是SO3(s),该反应的焓变不代表S的燃烧热,故C错误;
D.可燃物C6H12O6(s)的物质的量是1 mol,反应中C→CO2、H→H2O(液),反应放出的热量是燃烧热,故D正确;
故选D.
点评 本题考查了反应热与焓变的应用,题目难度不大,明确燃烧热的概念为解答关键,注意熟练掌握热化学方程式的书写原则,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
19.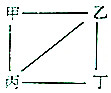 X、Y、Z、W为原子序数递增的4种短周期元素,其中Y、Z为金属元素.X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系(图中“-”相连的两种物质能发生反应).下列判断一定正确的是( )
X、Y、Z、W为原子序数递增的4种短周期元素,其中Y、Z为金属元素.X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系(图中“-”相连的两种物质能发生反应).下列判断一定正确的是( )
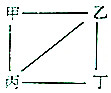 X、Y、Z、W为原子序数递增的4种短周期元素,其中Y、Z为金属元素.X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系(图中“-”相连的两种物质能发生反应).下列判断一定正确的是( )
X、Y、Z、W为原子序数递增的4种短周期元素,其中Y、Z为金属元素.X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系(图中“-”相连的两种物质能发生反应).下列判断一定正确的是( )| A. | X是元素周期表中非金属性最强的元素 | |
| B. | Z位于元素周期表第3周期IA族 | |
| C. | 4种原子中,Y原子半径最大 | |
| D. | W的最高化合价为+7 |
13.下列说法正确的是( )
| A. | 非金属元素组成的化合物中只可能含有共价键 | |
| B. | VIIA族元素气态氢化物的热稳定性从上到下依次减弱 | |
| C. | 第二周期元素原子的半径从左到右依次增大 | |
| D. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 |
7. Ⅰ、已知 KI溶液在酸性条件下能与氧气反应. 现有以下实验记录:
Ⅰ、已知 KI溶液在酸性条件下能与氧气反应. 现有以下实验记录:
回答下列问题:
(1)该反应的离子方程式为4H++4I-+O2=2I2+2H2O.
(2)该实验的目的是探究温度对反应速率的影响.
(3)实验试剂除了1mol/L KI溶液、0.1mol/L H2SO4溶液外,还需要的试剂是淀粉溶液,实验现象为无色溶液变蓝色.
(4)由上述实验记录可得出的结论是每升高10℃,反应速率增大约2倍
(5)若要进行酸性对反应速率的影响的探究实验,你会采取的措施是保持其他实验条件不变,采用不同浓度的硫酸溶液进行对比实验
Ⅱ、分别取40mL 0.50mol/L盐酸与 0.55mol/L NaOH溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g•℃).实验时,还需测量的数据有ACE.
A.反应前盐酸溶液的温度 B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
某学生实验记录数据如表:
依据该学生的实验数据计算,该实验测得的中和热为△H=-51.8kJ/mol.
假定该学生的操作完全同上,实验中改用100mL 0.50mol/L盐酸跟100mL 0.55mol/L NaOH溶液进行反应,与上述实验相比所求中和热相等(填“相等”或“不相等”).
 Ⅰ、已知 KI溶液在酸性条件下能与氧气反应. 现有以下实验记录:
Ⅰ、已知 KI溶液在酸性条件下能与氧气反应. 现有以下实验记录:| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度(℃) | 30 | 40 | 50 | 60 | 70 |
| 显色时间(s) | 160 | 80 | 40 | 20 | 10 |
(1)该反应的离子方程式为4H++4I-+O2=2I2+2H2O.
(2)该实验的目的是探究温度对反应速率的影响.
(3)实验试剂除了1mol/L KI溶液、0.1mol/L H2SO4溶液外,还需要的试剂是淀粉溶液,实验现象为无色溶液变蓝色.
(4)由上述实验记录可得出的结论是每升高10℃,反应速率增大约2倍
(5)若要进行酸性对反应速率的影响的探究实验,你会采取的措施是保持其他实验条件不变,采用不同浓度的硫酸溶液进行对比实验
Ⅱ、分别取40mL 0.50mol/L盐酸与 0.55mol/L NaOH溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g•℃).实验时,还需测量的数据有ACE.
A.反应前盐酸溶液的温度 B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
某学生实验记录数据如表:
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
假定该学生的操作完全同上,实验中改用100mL 0.50mol/L盐酸跟100mL 0.55mol/L NaOH溶液进行反应,与上述实验相比所求中和热相等(填“相等”或“不相等”).
14.用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A. | 7.8 g Na2O2中含有的阴离子数为0.2NA | |
| B. | 铜与浓硫酸反应中,当转移的电子数为0.2NA时,生成的SO2为2.24 L | |
| C. | 1 mol•L-1的NH4Cl溶液中的NH4+的数目小于NA | |
| D. | 由NO2、O2组成的混合物中共有NA个分子,其中的氧原子数目为2NA |
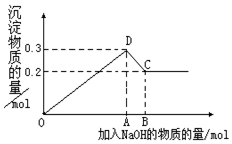 在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如图所示.则:
在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如图所示.则: