题目内容
下列离子方程式中正确的是
| A.氨水与亚硫酸溶液混合:NH3·H2O+H+=NH4++H2O |
| B.SO2通入漂白粉溶液中:Ca(ClO)2+SO2+H2O=CaSO3↓+2HClO |
C.铜与浓硫酸共热:Cu+4H++SO42- Cu2++SO2↑+2H2O Cu2++SO2↑+2H2O |
| D.把H2S通入CuSO4溶液中:H2S+Cu2+=CuS↓+2H+ |
D
解析试题分析:A、亚硫酸是弱酸,不能拆开,错误;B、SO2通入漂白粉溶液中应发生氧化还原反应,错误;C、浓硫酸在书写离子方程式时保持分子形式,不能拆开,错误;D、硫化氢与硫酸铜溶液反应生成难溶的硫化铜沉淀,正确,答案选D。
考点:考查离子方程式的书写

练习册系列答案
 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
某10 mL溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、K+、Fe3+、Mg2+、Al3+等离子,向溶液中逐滴加人1 mol/L的盐酸,生成沉淀物质的量与加入盐酸体积的关系如图所示,下列说法中正确的是( 
| A.原溶液肯定含有OH-、CO32-、AlO2-、SiO32-、Na+ |
B.若原溶液中只含有某一种阳离子(不考虑水电离出来的氢离子)且忽略反应前后溶液体积变化,那么该离子在原溶液中的物质的量浓度为等 |
| C.原溶液中n(CO32-):n(AlO2-)=3:4 |
| D.a值肯定等于4 |
下列离子在溶液中可大量共存,形成无色透明溶液的一组是
| A.K+、Na+、OH—、MnO4- | B.Ba2+、Cu2+、NO3—、SO42— |
| C.Mg2+、Na+、OH—、SO42— | D.Cl—、Ba2+、NO3—、OH— |
下列离子方程式正确的是
| A.Cl2通入水中:Cl2+H2O=2H+ +Cl-+ClO- |
| B.双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O |
C.用铜作电极电解CuSO4溶液:2Cu2++2H2O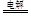 2Cu+O2↑+4H+ 2Cu+O2↑+4H+ |
| D.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe - 3e- = Fe3+ |
下列离子可以大量共存的是( )
| A.K +、SO42-、OH-、AlO2- | B.K +、Ag+ 、Cl-、NO3- |
| C.Ba2+ 、Na+ 、OH-、CO32- | D.Na+、NH4+ 、NO3-、OH- |
向FeCl3、Al2(SO4)3的混合溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示。沉淀的生成与溶解的pH列于下表。以下推断正确的是( )
| 氢氧化物 | 溶液pH | |||
| 开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 | |
| Fe(OH)3 | 2.3 | 3.4 | - | - |
| Al(OH)3 | 3.3 | 5.2 | 7.8 | 12.8 |

A.C点的沉淀为Fe(OH)3
B.OA段可能发生的反应有:3Ba2++6OH-+3SO42-+2Fe3+=3BaSO4↓+2Fe(OH)3↓
C.AB段可能发生的反应是:2SO42-+2Ba2++Al3++3OH-=2BaSO4↓+Al(OH)3↓
D.据图计算原溶液中c(Cl-)>c(SO42-)
若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,可能共存的是( )
| A.NH4+ NO3- CO32- Na+ |
| B.Na+Ba2+Mg2+HCO3- |
| C.NO3- K+AlO2- OH- |
| D.NO3- Ca2+K+Cl- |
下列解释事实的方程式不准确的是 ( )。
| A.用浓盐酸检验氨:NH3+HCl=NH4Cl |
B.碳酸钠溶液显碱性:CO32—+H2O HCO3—+OH- HCO3—+OH- |
| C.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+ |
| D.长期盛放石灰水的试剂瓶内壁出现白色固体:Ca(OH)2+CO2=CaCO3↓+H2O |
