题目内容
已知中和热的数值是57.3kJ?mol-1.下列物质反应时,产生57.3kJ热量的是( )
| A、稀HCl和稀NaOH |
| B、1.0mol?mol-1HCl和1.0 mol?mol-1NaOH |
| C、500mL 2.0 mol?mol-1HCl和500 mL2.0 mol?mol-1NaOH |
| D、500mL 2.0 mol?mol-1H2SO4和500 mL 2.0 mol?mol-1Ba(OH)2 |
考点:中和热
专题:化学反应中的能量变化
分析:在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热.必须是酸和碱的稀溶液,因为浓酸溶液和浓碱溶液在相互稀释时会放热.
强酸和强碱的稀溶液反应才能保证H+(aq)+OH-(aq)=H2O(l)中和热均为57.3 kJ?mol-1,而弱酸或弱碱在中和反应中由于电离吸收热量,反应不能生成沉淀,生成沉淀会放出热量.
强酸和强碱的稀溶液反应才能保证H+(aq)+OH-(aq)=H2O(l)中和热均为57.3 kJ?mol-1,而弱酸或弱碱在中和反应中由于电离吸收热量,反应不能生成沉淀,生成沉淀会放出热量.
解答:
解:A、稀HCl和稀NaOH反应生成的水的物质的量不一定是1mol,放出的热量不一定为57.3kJ,故A错误;
B、未给出体积,稀HCl和稀NaOH反应生成的水的物质的量不一定是1mol,放出的热量不一定为57.3kJ,故B错误;
C、稀HCl和稀NaOH,为强酸和强碱,反应生成1mol水,放出的热量为57.3kJ,故C正确;
D、生成的水的物质的量为2mol,且有硫酸钡沉淀生成,放出的热量比114.6kJ还要多,故D错误.
故选:C
B、未给出体积,稀HCl和稀NaOH反应生成的水的物质的量不一定是1mol,放出的热量不一定为57.3kJ,故B错误;
C、稀HCl和稀NaOH,为强酸和强碱,反应生成1mol水,放出的热量为57.3kJ,故C正确;
D、生成的水的物质的量为2mol,且有硫酸钡沉淀生成,放出的热量比114.6kJ还要多,故D错误.
故选:C
点评:考查对中和热的理解,难度不大,注意1.必须是酸和碱的稀溶液,因为浓酸溶液和浓碱溶液在相互稀释时会放热. 2.强酸和强碱的稀溶液反应才能保证H+(aq)+OH-(aq)=H2O(l)中和热均为57.3 kJ?mol-1,而弱酸或弱碱在中和反应中由于电离吸收热量,其中和热小于57.3 kJ?mol-1; 3.以生成1 mol水为基准. 4.反应不能生成沉淀(如Ba(OH)2+H2SO4=BaSO4+2H2O)

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是( )
| A、所用NaOH固体已潮解 |
| B、向容量瓶加水时,液面低于刻度线即摇匀 |
| C、定容时不小心加水超过了刻度线,用胶头滴管直接吸出多余部分 |
| D、有少量NaOH溶液残留在烧杯内 |
体积相同、pH相同的HCl溶液和CH3COOH溶液,用同浓度的NaOH溶液中和时( )
| A、两者消耗NaOH的物质的量相同 |
| B、中和HCl消耗NaOH的物质的量多 |
| C、中和CH3COOH消耗NaOH的物质的量多 |
| D、两者消耗NaOH的物质的量无法比较 |
1mol有机物 与足量氢气和新制氢氧化铜反应,消耗的氢气与氢氧化铜的量分别为( )
与足量氢气和新制氢氧化铜反应,消耗的氢气与氢氧化铜的量分别为( )
 与足量氢气和新制氢氧化铜反应,消耗的氢气与氢氧化铜的量分别为( )
与足量氢气和新制氢氧化铜反应,消耗的氢气与氢氧化铜的量分别为( )| A、1mol 2mol |
| B、3mol 4mol |
| C、3mol 2mol |
| D、1mol 4mol |
对铜-铁-稀硫酸组成的原电池装置中,当导线中有0.5mol电子通过时,理论上的两极变化是( )
①铁片增重了14克 ②铁片溶解了14克 ③铜片上析出0.5克氢气 ④铁片上析出0.5mol氢气.
①铁片增重了14克 ②铁片溶解了14克 ③铜片上析出0.5克氢气 ④铁片上析出0.5mol氢气.
| A、②③ | B、②④ | C、①③ | D、①④ |
下列物质中,具有同分异构体的有( )
(1)C3H7Cl (2)C3H8 (3)CH2Cl2.
(1)C3H7Cl (2)C3H8 (3)CH2Cl2.
| A、(1)(3) |
| B、(1)(2) |
| C、只有(3) |
| D、只有(1) |
在一定温度下,可逆反应X(g)+3Y(g)?2Z(g)已达到平衡的标志是( )
| A、单位时间内消耗nmolX同时生成2nmolZ |
| B、混合气体的平均摩尔质量不再变化 |
| C、X、Y、Z的平衡浓度相等 |
| D、V(X)、V(Y)、V(Z)的之比为1:3:2 |
下列说法不正确的是( )
| A、金属单质在反应中只能作还原剂,非金属单质只能作氧化剂 |
| B、金属元素从化合态到游离态,该元素一定被还原 |
| C、非金属元素在化合物中可能呈现正价态 |
| D、金属阳离子被还原不一定得到金属单质 |
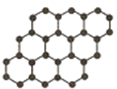 石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如图),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( )
石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如图),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( )| A、石墨烯与石墨互为同位素 |
| B、12g石墨烯中含有3NA个C-C键 |
| C、石墨烯是一种有机物 |
| D、石墨烯中的碳原子间以共价键结合 |