题目内容
16.写出下列物质的电子式:①KOH

②CO2
 .
.
分析 ①氢氧化钾为离子化合物,电子式需要标出阴阳离子所带电荷;
②二氧化碳中存在两个碳氧键,C、O原子最外层都达到最外层8个电子;
解答 解:①氢氧化钾中存在钾离子和氢氧根离子,氢氧化钾的电子式为: ,
,
故答案为: ;
;
②二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: ,
,
故答案为: .
.
点评 本题考查了电子式的书写,题目难度不大,注意掌握电子式的概念及书写原则,明确离子化合物与共价化合物的电子式表示方法及区别.

练习册系列答案
相关题目
6.草酸(H2C2O4)与高锰酸钾在酸性条件下能够发生如下反应:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,【实验1】甲同学用8.00mL 0.001mol/L KMnO4溶液与5.00mL 0.01mol/L H2C2O4溶液反应,研究不同条件对化学反应速率的影响.改变的条件如表:
(1)如果研究温度对化学反应速率的影响,可用实验Ⅰ和Ⅱ作对比(用Ⅰ~III表示).
(2)对比实验Ⅰ和 III,可以研究c(H+)(或硫酸溶液的浓度)对化学反应速率的影响,实验Ⅲ中加入2.00mL蒸馏水的目的是确保实验中c(KMnO4)、c(H2C2O4)不变和总体积不变,可使Ⅰ和Ⅲ中硫酸浓度不同.
【实验2】乙同学在研究草酸与高锰酸钾在酸性条件下反应的影响因素时发现,草酸与酸性高锰酸钾溶液开始一段时间反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快.
(3)针对上述现象,乙同学认为草酸与高锰酸钾反应放热,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你猜想还可能是催化剂的影响.
(4)若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是D(填字母).
A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰.
| 组别 | KMnO4溶液 /ml | H2C2O4溶液 /ml | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 8.00 | 5.00 | 3.00 | 20 | |
| Ⅱ | 8.00 | 5.00 | 3.00 | 30 | |
| Ⅲ | 8.00 | 5.00 | 1.00 | 20 | 2.00mL 蒸馏水 |
(2)对比实验Ⅰ和 III,可以研究c(H+)(或硫酸溶液的浓度)对化学反应速率的影响,实验Ⅲ中加入2.00mL蒸馏水的目的是确保实验中c(KMnO4)、c(H2C2O4)不变和总体积不变,可使Ⅰ和Ⅲ中硫酸浓度不同.
【实验2】乙同学在研究草酸与高锰酸钾在酸性条件下反应的影响因素时发现,草酸与酸性高锰酸钾溶液开始一段时间反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快.
(3)针对上述现象,乙同学认为草酸与高锰酸钾反应放热,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你猜想还可能是催化剂的影响.
(4)若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是D(填字母).
A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰.
7.1-18号部分元素的主要信息见下表
(1)Z在元素周期表中的位置是第三周期IA族.
(2)Y、M、Z的原子半径由大到小的顺序为Na>S>F.(用元素符号表示)
(3)W单质燃烧不能用CO2灭火,用化学方程式表示其理由2Mg+CO2 $\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(4)X与Y形成的化合物可用来雕刻玻璃,该反应的化学方程式为4HF+SiO2=SiF4↑+2H2O.
(5)设计实验比较Z和W的金属性强弱钠与冷水比镁与冷水反应剧烈,因此钠的金属性强于镁.(指出实验中的操作、现象及结论)
(6)NT2常用于水的净化,工业上可用N的单质氧化NT2 -溶液制取NT2.写出该反应的离子反应方程式,并标出电子转移的方向和数目: .
.
(7)M的一种氧化物是一种常见的大气污染物,可用碱液来吸收.1L1mol/L的NaOH溶液最多能吸收该氧化物的体积为22.4L(标准状况).
| 元素代号 | X | T | Y | Z | W | M | N |
| 主要化合价 | +1 | -2 | -1 | +1 | +2 | +2、-2 | +7、-1 |
| 结构或用途 | 原子半径最小 | 地壳中含量最高的元素 | 非金属性最强 | 一种含氧化物可用作供氧剂 | 次外层电子数是最外层电子数的4倍 |
(2)Y、M、Z的原子半径由大到小的顺序为Na>S>F.(用元素符号表示)
(3)W单质燃烧不能用CO2灭火,用化学方程式表示其理由2Mg+CO2 $\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(4)X与Y形成的化合物可用来雕刻玻璃,该反应的化学方程式为4HF+SiO2=SiF4↑+2H2O.
(5)设计实验比较Z和W的金属性强弱钠与冷水比镁与冷水反应剧烈,因此钠的金属性强于镁.(指出实验中的操作、现象及结论)
(6)NT2常用于水的净化,工业上可用N的单质氧化NT2 -溶液制取NT2.写出该反应的离子反应方程式,并标出电子转移的方向和数目:
 .
.(7)M的一种氧化物是一种常见的大气污染物,可用碱液来吸收.1L1mol/L的NaOH溶液最多能吸收该氧化物的体积为22.4L(标准状况).
4.下列说法正确的是( )
| A. | 只含H、N、O三种元素的化合物,可能是离子化含物,也可能是共价化合物 | |
| B. | 元素周期表中,ⅠA族与ⅦA族元素间只能形成离子化合物 | |
| C. | NaHCO3、CH3COONa均含有离子键和共价键 | |
| D. | 化合物MgO、SiO2、SO3中化学键的类型相同 |
11.现有如下各种说法( )
①在水中氢、氧原子均以化学键相结合
②化学键是成键原子间的强烈吸引作用
③离子化合物通常条件下是固体
④难失去电子的原子,均易得电子形成阴离子
⑤根据电离方程式H2SO4═2H++SO42-,判断H2SO4中存在离子键
⑥单质分子中不存在化学键,化合物分子中才存在化学键
⑦H2分子和Cl2分子的反应过程是H2、Cl2分子里共价键发生断裂生成H、Cl原子,而后H、Cl原子形成离子键的过程.
①在水中氢、氧原子均以化学键相结合
②化学键是成键原子间的强烈吸引作用
③离子化合物通常条件下是固体
④难失去电子的原子,均易得电子形成阴离子
⑤根据电离方程式H2SO4═2H++SO42-,判断H2SO4中存在离子键
⑥单质分子中不存在化学键,化合物分子中才存在化学键
⑦H2分子和Cl2分子的反应过程是H2、Cl2分子里共价键发生断裂生成H、Cl原子,而后H、Cl原子形成离子键的过程.
| A. | ①②③正确 | B. | 都不正确 | ||
| C. | ⑥⑦正确,其它不正确 | D. | 仅③正确 |
1.利用下列实验装置能完成相应实验的是( )
| A. |  制取并收集干燥纯净的NH3 | B. |  模拟海水蒸馏 | ||
| C. |  收集NO2气体 | D. |  包有足量Na2O2的脱脂面燃烧 |
8.下列离子方程式正确的是( )
| A. | 硫酸铝溶液中加过量氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | 过量铁粉与一定量稀硝酸反应:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 用热的浓盐酸除去试管内壁的MnO2:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| D. | 澄清石灰水中加入过量NaHCO3溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |

 .A中反应的氧化剂和还原剂的物质的量之比为1:2.
.A中反应的氧化剂和还原剂的物质的量之比为1:2.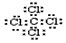 ,用一个离子方程式证明S(硫)元素和U元素的非金属性的强弱S2-+Cl2=S+2Cl-或H2S+Cl2=2H++2Cl-+S.
,用一个离子方程式证明S(硫)元素和U元素的非金属性的强弱S2-+Cl2=S+2Cl-或H2S+Cl2=2H++2Cl-+S.