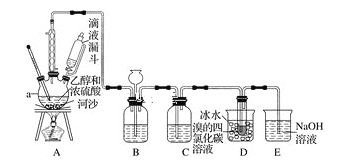
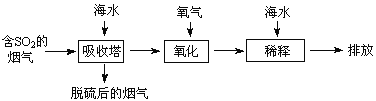
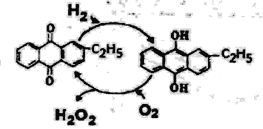
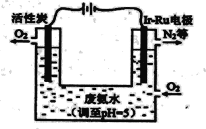
题目内容
【题目】如图是l mol金属镁和卤素反应的△H(单位:kJ· mol-1)示意图,反应物和生成物均为常温时的稳定状态,下列选项中不正确的是
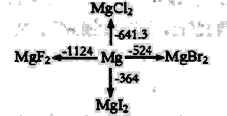
A.由图可知,MgF2(s)+Br2(l)=MgBr2(s)+F2(g)△H=+600kJ· mol-1
B.MgI2与Br2反应的△H<0
C.电解MgBr2制Mg是吸热反应
D.化合物的热稳定性顺序:MgI2>MgBr2>MgCl2>MgF2
【答案】D
【解析】
A.Mg(s)+F2(l)=MgF2(s)△H=-1124kJ·mol-1,Mg(s)+Br2(l)=MgBr2(s)△H=-524kJ·mol-1,依据盖斯定律计算得到选项中热化学方程式分析判断;
B.溴化镁的能量小于碘化镁的能量,溴的能量大于碘的能量,所以MgI2与Br2反应是放热反应;
C.生成溴化镁为放热反应,其逆反应为吸热反应;
D.能量越小的物质越稳定。
A.Mg(s)+F2(l)=MgF2(s)△H=-1124kJ·mol-1,Mg(s)+Br2(l)=MgBr2(s)△H=-524kJ·mol-1,将第二个方程式与第一方程式相减得MgF2(s)+Br2(L)=MgBr2(s)+F2(g)△H=+600kJ·mol-1,故A正确;
B.溴化镁的能量小于碘化镁的能量,溴的能量大于碘的能量,所以MgI2与Br2反应是放热反应, MgI2与Br2反应的△H<0,故B正确;
C. 生成溴化镁为放热反应,其逆反应为吸热反应,电解MgBr2制Mg是吸热反应,故C正确;
D.能量越小的物质越稳定,所以化合物的热稳定性顺序为MgI2<MgBr2<MgCl2<MgF2,故D错误;
故选:D。

【题目】氯气是一种重要的工业原料,液氯储存区贴有的说明卡如下:
包装 | 钢瓶 |
储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
下列解释事实的方程式不正确的是
A. 氯气用于自来水消毒:Cl2 + H2O![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
B. 电解饱和食盐水制取Cl2:2Cl- +2H2O![]() 2OH-+ H2↑+Cl2↑
2OH-+ H2↑+Cl2↑
C. 浓氨水检验泄露的氯气,产生白烟:8NH3 + 3Cl2 === 6 NH4Cl + N2
D. 氯气“泄漏处理”中NaHSO3溶液的作用:HSO3-+ Cl2 + H2O === SO42-+ 3H+ + 2Cl-
【题目】部分弱酸的电离平衡常数如表:
弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
电离平衡 常数(25℃) | Ka=1.77×10-4 | Ka=4.0×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)室温下①0.1mol·L-1HCOONa,②0.1mol·L-1NaClO,③0.1mol·L-1Na2CO3,④0.1mol·L-1NaHCO3溶液的pH由大到小的关系为_______________________。
(2)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为_______________________。
(3)下列离子方程式正确的是___________(填字母)。
A.2ClO-+H2O+CO2=2HClO+CO32-
B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.H2SO3+=2HCOO-=2HCOOH+SO32-
D.Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-
(4)某温度(T℃)下的溶液中,c(H+)=10-xmol·L-1,c(HO-)=10-ymol·L-1,x与y的关系如图所示。
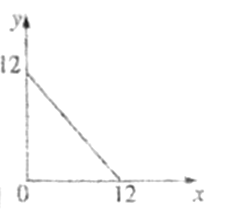
①此温度下,0.01mol/L的NaOH溶液中水电离出的OH-浓度为____________。
②在此温度下,0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1mol·L-1的Ba(OH)2 | 10 | 10 | 10 | 10 |
0.1mol·L-1的NaHSO4 | 5 | 10 | 15 | 20 |
按丁方式混合后,所得溶液显____________(填“酸”“碱”或“中”)性,写出按乙方式混合后,反应的离子方程式:______________。按甲方式混合后,所得溶液的pH为____________。