题目内容
 (Ⅰ)(石油是现代工业的血液,乙烯的年产量可以衡量一个国家石油化工发展水平.请回答下列问题.
(Ⅰ)(石油是现代工业的血液,乙烯的年产量可以衡量一个国家石油化工发展水平.请回答下列问题.(1)①乙烯的结构式为
②下列物质中,不可以通过乙烯发生加成反应得到的是
A.CH3CH3
B.CH3CHCl2
C.CH3CH2OH
D.CH3CH2Br
③工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方
程式为
(2)已知 2CH3CHO+O2
| 催化剂 |
乙烯
| Ⅰ |
| Ⅱ |
| Ⅲ |
①反应Ⅱ的化学方程式为
②写出A与乙酸反应的化学方程式
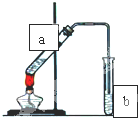
(Ⅱ)实验室可用如图装置制取少量乙酸乙酯,请回答下列问题:
(1)同学甲在试管a中加入乙酸和乙醇,加热后却得不到乙酸乙酯原因是:
(2)试管b中装有的物质是
(3)若要把b中的乙酸乙酯分离出来,必须使用的玻璃仪器是
(4)同学乙在试管a中加入3克乙酸和足量乙醇采用适当条件使反应充分进行,结束后在试管a回收到1.2克乙酸,则同学乙在本次实验中制得乙酸乙酸的最大质量为
考点:乙酸乙酯的制取,乙烯的化学性质
专题:实验题,有机反应
分析:(Ⅰ)(1)①乙烯分子式为C2H4,分子中含有碳碳双键;
②依据乙烯含有双键能够与氢气、氯化溴、水等发生加成反应解答;
③乙烯含有碳碳双键,能够发生加聚反应生成高分子化合物聚乙烯;
(2)由转化关系可知A为乙醇,B为乙醛,以此解答该题.
①乙醇发生催化氧化生成乙醛;
②乙醇和乙酸发生酯化反应生成乙酸乙酯和水;
(Ⅱ)(1)乙酸乙酯的制备除了反应原料,加热,还需要催化剂才能进行,依此进行作答;
(2)制备乙酸乙酯时常用饱和碳酸钠溶液,饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;根据导管伸入液面下可能发生倒吸分析;
(3)分离互不相溶的液体,可用分液的方法分离,分液操作用到的主要仪器是分液漏斗;
(4)反应消耗乙酸的质量为3g-1.2g=1.8g,物质的量为
=0.03mol,理论上生成乙酸乙酯0.03mol,质量为0.03mol×88g/mol=2.64g.
②依据乙烯含有双键能够与氢气、氯化溴、水等发生加成反应解答;
③乙烯含有碳碳双键,能够发生加聚反应生成高分子化合物聚乙烯;
(2)由转化关系可知A为乙醇,B为乙醛,以此解答该题.
①乙醇发生催化氧化生成乙醛;
②乙醇和乙酸发生酯化反应生成乙酸乙酯和水;
(Ⅱ)(1)乙酸乙酯的制备除了反应原料,加热,还需要催化剂才能进行,依此进行作答;
(2)制备乙酸乙酯时常用饱和碳酸钠溶液,饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;根据导管伸入液面下可能发生倒吸分析;
(3)分离互不相溶的液体,可用分液的方法分离,分液操作用到的主要仪器是分液漏斗;
(4)反应消耗乙酸的质量为3g-1.2g=1.8g,物质的量为
| 1.8g |
| 60g/mol |
解答:
解:(Ⅰ)(1)①乙烯分子式为C2H4,分子中含有碳碳双键,结构式为 ,故答案为:
,故答案为: ;
;
②A.乙烯与氢气发生加成生成乙烷,故A正确;
B.依据加成反应原理,可知CH3CHCl2,不能由乙烯通过加成反应制得,故B错误;
C.乙烯与水加成生成乙醇,故C正确;
D.乙烯与溴化氢加成生成CH3CH2Br,故D正确;
故答案为:B;
③乙烯加聚生成聚乙烯,反应的化学方程式为: ,反应的类型为加聚反应;
,反应的类型为加聚反应;
故答案为: ,加聚反应;
,加聚反应;
(2)由转化关系可知A为乙醇,B为乙醛,
①乙醇发生催化氧化生成乙醛,化学方程式为2CH3CH2OH+O2
2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2
2CH3CHO+2H2O;
②乙醇和乙酸发生酯化反应生成乙酸乙酯和水,化学方程式为CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O,
CH3COOCH2CH3+H2O,
故答案为:CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(Ⅱ)(1)乙酸乙酯的制备反应,反应原料为乙酸和乙醇,浓硫酸起催化作用,因此未收集到有香味液体的原因是未加催化剂浓硫酸,
故答案为:未加浓硫酸作催化剂;
(2)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯;导管不能插入溶液中,导管要插在饱和碳酸钠溶液的液面上,伸入液面下可能发生倒吸,
故答案为:饱和碳酸钠溶液;除去乙酸和乙醇,降低乙酸乙酯的溶解度;防止倒吸;
(3)分离乙酸乙酯时先将盛有混合物的试管充分振荡,让饱和碳酸钠溶液中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,静置分层后取上层得乙酸乙酯,分液操作用到的主要仪器是分液漏斗,
故答案为:分液漏斗;
(4)反应消耗乙酸的质量为3g-1.2g=1.8g,物质的量为
=0.03mol,理论上生成乙酸乙酯0.03mol,质量为0.03mol×88g/mol=2.64g,
故答案为:2.64g.
 ,故答案为:
,故答案为: ;
;②A.乙烯与氢气发生加成生成乙烷,故A正确;
B.依据加成反应原理,可知CH3CHCl2,不能由乙烯通过加成反应制得,故B错误;
C.乙烯与水加成生成乙醇,故C正确;
D.乙烯与溴化氢加成生成CH3CH2Br,故D正确;
故答案为:B;
③乙烯加聚生成聚乙烯,反应的化学方程式为:
 ,反应的类型为加聚反应;
,反应的类型为加聚反应;故答案为:
 ,加聚反应;
,加聚反应;(2)由转化关系可知A为乙醇,B为乙醛,
①乙醇发生催化氧化生成乙醛,化学方程式为2CH3CH2OH+O2
| Cu或Ag |
| △ |
| Cu或Ag |
| △ |
②乙醇和乙酸发生酯化反应生成乙酸乙酯和水,化学方程式为CH3COOH+CH3CH2OH
 CH3COOCH2CH3+H2O,
CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH
 CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;(Ⅱ)(1)乙酸乙酯的制备反应,反应原料为乙酸和乙醇,浓硫酸起催化作用,因此未收集到有香味液体的原因是未加催化剂浓硫酸,
故答案为:未加浓硫酸作催化剂;
(2)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯;导管不能插入溶液中,导管要插在饱和碳酸钠溶液的液面上,伸入液面下可能发生倒吸,
故答案为:饱和碳酸钠溶液;除去乙酸和乙醇,降低乙酸乙酯的溶解度;防止倒吸;
(3)分离乙酸乙酯时先将盛有混合物的试管充分振荡,让饱和碳酸钠溶液中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,静置分层后取上层得乙酸乙酯,分液操作用到的主要仪器是分液漏斗,
故答案为:分液漏斗;
(4)反应消耗乙酸的质量为3g-1.2g=1.8g,物质的量为
| 1.8g |
| 60g/mol |
故答案为:2.64g.
点评:本题考查了乙烯的结构和性质、乙酸乙酯的制备,综合性教强,为高频考点,掌握烯烃-醇-醛-酸-酯类的相互转化以及乙酸乙酯制备过程中饱和碳酸钠、乙酸、乙醇的性质是解题的关键,难度一般.

练习册系列答案
相关题目
下列变化过程属于放热反应的是( )
①浓硫酸的稀释
②碘的升华
③NaOH固体溶于水
④氢氧化钡晶体与氯化铵混合
⑤H2在Cl2中燃烧
⑥Al在高温条件下与Fe2O3 的反应 ⑦酸碱中和反应.
①浓硫酸的稀释
②碘的升华
③NaOH固体溶于水
④氢氧化钡晶体与氯化铵混合
⑤H2在Cl2中燃烧
⑥Al在高温条件下与Fe2O3 的反应 ⑦酸碱中和反应.
| A、①③⑤ | B、②④⑥ |
| C、⑤⑥⑦ | D、①③⑤⑥ |
下列解释实验事实的化学方程式正确的是( )
| A、向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:Ba2++NH4++Al3++SO42-+4OH-═Al(OH)3↓+NH3?H2O+BaSO4↓ |
| B、KMnO4和H2O2在酸性条件下反应:2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O |
| C、在电解质溶液为氢氧化钾的甲醇燃料电池内电路中,负极的电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O |
| D、向NaAlO2溶液中通入过量CO2:CO2+3H2O+2AlO2-=2Al(OH)3↓+CO32- |
下列各组反应中最终肯定是白色沉淀的是( )
| A、AlCl3溶液中加入过量氨水 |
| B、Al2(SO4)3溶液中加入过量KOH溶液 |
| C、FeCl2溶液中加入过量氨水 |
| D、Fe2(SO4)3溶液中加入过量KOH溶液 |
 把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol/L的NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示.则有( )
把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol/L的NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示.则有( )| A、镁铝合金的质量为0.39 g |
| B、盐酸的物质的量浓度为2mol/L |
| C、B点沉淀的质量 0.39g |
| D、镁铝与盐酸恰好完全反应 |

