题目内容
10.用98%的浓硫酸(其密度为1.84g/cm3)配制100mL 1.0mol•L-1稀硫酸,若实验仪器有:A、100mL量筒 B、托盘天平 C、玻璃棒 D、50mL容量瓶 E、10mL量筒 F、胶头滴管 G、50mL烧杯 H、100mL容量瓶
(1)需量取浓硫酸的体积为5.4mL;
(2)实验时选用的仪器有(填序号)CEFGH;
(3)配制过程中,下列情况会使配制结果偏高的是(填序号)①;
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(4)在容量瓶使用方法中,下列操作不正确的是(填序号)BCD:
A、使用容量瓶前检查它是否漏水;
B、容量瓶用蒸馏水洗净后,再用待配液润洗;
C、将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中;
D、将准确量取的18.4mol•L-1的硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线;
E、定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀.
分析 (1)先计算出浓硫酸的物质的量浓度为c=$\frac{1000ρω}{M}$,然后根据溶液稀释前后物质的量不变计算所需浓硫酸的体积;
(2)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器;
(3)根据c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积的影响判断;
(4)容量瓶是比较精密的仪器,不能受热,不能用于稀释浓溶液和溶解固体,由于摇匀时要倒转,故使用前必须查漏.
解答 解:(1)浓硫酸的物质的量浓度为c=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,设所需浓硫酸的体积为V,则有V×18.4mol/L=O.1L×1mol/L,
则V=$\frac{0.1L×1mol/L}{18.4mol/L}$=O.0054L=5.4mL,故答案为:5.4;
(2)操作步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取,在烧杯中稀释,冷却后转移到100ml容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为筒量、胶头滴管、烧杯、玻璃棒、100mL容量瓶,故答案为:CEFGH;
(3)①定容观察液面时俯视,溶液体积偏小,浓度偏大,故①正确;
②容量瓶使用时未干燥,无影响,浓度不变,故②错误;
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线,由于刻度线以上的滞留溶液会下来,溶液的体积偏大,浓度偏低,故③错误;
故答案为:①;
(4)A、使用容量瓶前要检查它是否漏水,防止在配制溶液过程中漏液,故A正确;
B、容量瓶用蒸馏水洗净后,再用待配液润洗,会导致所配溶液浓度偏大,故B错误;
C、氢氧化钠易潮解,故应放到烧杯中称量,氢氧化钠在溶解过程中会放热,要等冷却至室温再转移进容量瓶,故C错误;
D、配制溶液时,要先稀释,冷却至室温以后,再转移至容量瓶,故D错误;
E、摇匀时食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转反复上下摇匀,故E正确.
故选BCD.
点评 本题考查了一定物质的量浓度溶液的配制以及容量瓶的使用,注意实验的基本操作方法和注意事项,误差分析时,注意从c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积的影响判断.

 中考解读考点精练系列答案
中考解读考点精练系列答案| A. | v(D)=0.6 mol•L-1•min-1 | B. | v(B)=0.45 mol•L-1•s-1 | ||
| C. | v(C)=0.40 mol•L-1•min-1 | D. | v(A)=0.2 mol•L-1•s-1 |
| A. | 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸根 | |
| B. | 某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42- | |
| C. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- | |
| D. | 某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 |




 发生酯化反应的产物.
发生酯化反应的产物. 、
、 、
、 (其中之一).
(其中之一).

 .
. 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题: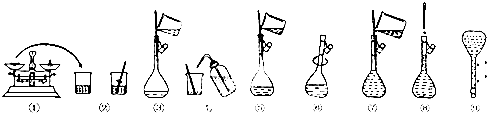
 如图所示是分离某种混合物时实验装置,请完成下列问题:
如图所示是分离某种混合物时实验装置,请完成下列问题:
 ;
; .
.