题目内容
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、28 g C2H4中含有2 NA个碳原子 |
| B、常温常压下,22.4L氦气含有的原子数为2NA |
| C、1mol S在足量O2中燃烧,转移的电子数为6 NA |
| D、0.1 mol?L-1的碳酸氢钠溶液中含钠离子数为0.1NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.乙烯的摩尔质量为28g/mol,28g乙烯的物质的量为1mol,含有2mol碳原子;
B.常温常压下,不能使用标况下的气体摩尔体积计算氦气的物质的量,且稀有气体为单原子分子;
C.硫单质在空气中燃烧生成二氧化硫,1molS单质完全反应转移了4mol电子;
D.缺少碳酸氢钠溶液的体积,无法计算溶液中钠离子的数目.
B.常温常压下,不能使用标况下的气体摩尔体积计算氦气的物质的量,且稀有气体为单原子分子;
C.硫单质在空气中燃烧生成二氧化硫,1molS单质完全反应转移了4mol电子;
D.缺少碳酸氢钠溶液的体积,无法计算溶液中钠离子的数目.
解答:
解:A.28g乙烯的物质的量为1mol,1mol乙烯分子中含有2mol碳原子,含有2NA个碳原子,故A正确;
B.稀有气体为单原子分子,且不是标况下,不能使用标况下的气体摩尔体积计算22.4L氦气的物质的量,故B错误;
C.1molS单质完全反应生成二氧化硫转移了4mol电子,转移的电子数为4NA,故C错误;
D.没有告诉碳酸氢钠溶液的体积,无法计算溶液中钠离子的物质的量及数目,故D错误;
故选A.
B.稀有气体为单原子分子,且不是标况下,不能使用标况下的气体摩尔体积计算22.4L氦气的物质的量,故B错误;
C.1molS单质完全反应生成二氧化硫转移了4mol电子,转移的电子数为4NA,故C错误;
D.没有告诉碳酸氢钠溶液的体积,无法计算溶液中钠离子的物质的量及数目,故D错误;
故选A.
点评:本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项B为易错点,注意稀有气体为单原子分子,还要明确标况下气体摩尔体积的使用条件.

练习册系列答案
相关题目
下列物质中的杂质(括号内为杂质)的检验、除杂的试剂或方法正确的是( )
| 物质及其杂质 | 检验 | 除杂 |
| A.Cl2(HCl) | 湿润的淀粉KI试纸 | 饱和食盐水 |
| B.NaHCO3溶液(Na 2CO3) | Ca(OH)2溶液 | 过量CO2 |
| C.CO2(HCl) | AgNO3溶液(含稀硝酸) | 饱和Na2CO3溶液 |
| D.NO(NO2) | 观察颜色或湿润的淀粉KI试纸 | 水 |
| A、Cl2(HCl) |
| B、NaHCO3溶液(Na 2CO3) |
| C、CO2(HCl) |
| D、NO(NO2) |
下列变化过程属于放热反应的是( )
①浓硫酸的稀释
②碘的升华
③NaOH固体溶于水
④氢氧化钡晶体与氯化铵混合
⑤H2在Cl2中燃烧
⑥Al在高温条件下与Fe2O3 的反应 ⑦酸碱中和反应.
①浓硫酸的稀释
②碘的升华
③NaOH固体溶于水
④氢氧化钡晶体与氯化铵混合
⑤H2在Cl2中燃烧
⑥Al在高温条件下与Fe2O3 的反应 ⑦酸碱中和反应.
| A、①③⑤ | B、②④⑥ |
| C、⑤⑥⑦ | D、①③⑤⑥ |
下列化学反应中反应类型与其它反应不同的是(反应条件略)( )
A、HOCH2CH2CH2CH2COOH?H2O+ |
| B、CH2BrCH2Br+2NaOH→CH≡CH↑+2NaBr+2H2O |
| C、CH3CHOHCH3→CH2=CHCH3↑+H2O |
| D、CH3CH2Cl→CH2=CH2↑+H2O |
甲苯 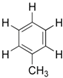 苯环上的一个氢原子被含3个碳原子的烷基所取代,可能得到的一元取代物有( )
苯环上的一个氢原子被含3个碳原子的烷基所取代,可能得到的一元取代物有( )
 苯环上的一个氢原子被含3个碳原子的烷基所取代,可能得到的一元取代物有( )
苯环上的一个氢原子被含3个碳原子的烷基所取代,可能得到的一元取代物有( )| A、3种 | B、4种 | C、5种 | D、6种 |
向一定量的饱和NaOH溶液中加入少量Na2O2固体,恢复到原来温度时,下列说法中正确的是( )
| A、溶液中的Na+总数增大 |
| B、溶液的碱性增强 |
| C、溶质的质量分数不变 |
| D、溶液的质量不变 |
下列解释实验事实的化学方程式正确的是( )
| A、向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:Ba2++NH4++Al3++SO42-+4OH-═Al(OH)3↓+NH3?H2O+BaSO4↓ |
| B、KMnO4和H2O2在酸性条件下反应:2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O |
| C、在电解质溶液为氢氧化钾的甲醇燃料电池内电路中,负极的电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O |
| D、向NaAlO2溶液中通入过量CO2:CO2+3H2O+2AlO2-=2Al(OH)3↓+CO32- |
