题目内容
7.下列说法中正确的是( )| A. | PM2.5是指空气中氮氧化物和硫氧化物含量之和 | |
| B. | 鸡蛋清溶液中滴加醋酸铅溶液会发生盐析 | |
| C. | 使用无铅汽油的汽车尾气不会污染空气 | |
| D. | 水体中植物营养物质过多积累会引起水体富营养化 |
分析 A.PM2.5是指空气中直径≤2.5μm的颗粒物;
B.铅离子为重金属离子,能够使蛋白质发生变性;
C.使用无铅汽油的汽车尾气依然可以产生氮的氧化物污染空气;
D.水中氮、磷元素的增多会引起水体的富营养化污染.
解答 解:A.PM2.5是指空气中直径≤2.5μm的颗粒物,不是指空气中氮氧化物和硫氧化物含量之和,故A错误;
B.鸡蛋清溶液中滴加醋酸铅溶液会发生变性,不是盐析,故B错误;
C.使用无铅汽油的汽车尾气可以降低铅离子污染,但仍然可以产生氮的氧化物等污染物,故C错误;
D.氮、磷元素,是植物的营养元素,水中氮、磷元素的增多会引起水体的富营养化污染,故D正确;
故选D.
点评 本题考查环境污染及治理,题目难度不大,明确常见环境污染类型、成因及治理措施为解答关键,试题有利于提高学生的环境保护意识.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
17.下列气体为有色气体的是( )
| A. | SO2 | B. | NO | C. | NO2 | D. | NH3 |
18.硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同.设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分.

(1)B装置的作用是检验产物中是否有水生成.
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有SO2气体产生,写出D中发生反应的离子方程式SO2+H2O2+Ba2+=BaSO4↓+2H+.若去掉C,能否得出同样结论否(填“是”或“否”),原因是若有SO3也有白色沉淀生成.
(3)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3,而不含FeO,请帮他完成表中内容.(试剂,仪器和用品自选)
(4)若E中收集到的气体只有N2,其物质的量为xmol,固体残留物Fe2O3的物质的量为ymol,D中沉淀物质的量为zmol,则x、y和z应满足的关系为3x+y=z.
(5)结合上述实验现象,完成硫酸亚铁铵在500℃时隔绝空气加热完全分解的化学方程式2(NH4)2Fe(SO4)2═Fe2O3+2 NH3↑+N2↑+4SO2↑+5H2O.

(1)B装置的作用是检验产物中是否有水生成.
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有SO2气体产生,写出D中发生反应的离子方程式SO2+H2O2+Ba2+=BaSO4↓+2H+.若去掉C,能否得出同样结论否(填“是”或“否”),原因是若有SO3也有白色沉淀生成.
(3)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3,而不含FeO,请帮他完成表中内容.(试剂,仪器和用品自选)
| 实验步骤 | 预期现象 | 结论 |
| 取少量A中残留物于试管中,加入适量稀硫酸,充分振荡使其完全溶解;将溶液分成两份,分别滴加高锰酸钾溶液、KSCN溶液 | 若高锰酸钾溶液不褪色,加入KSCN溶液后变红 | 固体残留物仅为Fe2O3 |
(5)结合上述实验现象,完成硫酸亚铁铵在500℃时隔绝空气加热完全分解的化学方程式2(NH4)2Fe(SO4)2═Fe2O3+2 NH3↑+N2↑+4SO2↑+5H2O.
15.分子式为C5H12O的醇与分子式为C8H8O2的芳香酸在一定条件下反应生成的酯有( )
| A. | 32种 | B. | 24种 | C. | 16种 | D. | 8种 |

 在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请用如图实验装置,选用适当的化学试剂和实验用品,设计并完成对过氧化钠这一性质的探究.
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请用如图实验装置,选用适当的化学试剂和实验用品,设计并完成对过氧化钠这一性质的探究.
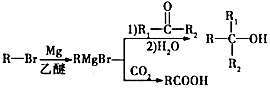
 ,其反应类型为取代反应.
,其反应类型为取代反应. .
. (写结构简式).
(写结构简式).
 .
. .
.