题目内容
6.下列说法正确的是( )| A. | 一定温度下,向饱和NaOH溶液中加入一小块钠,充分反应后恢复到原来温度,溶液的pH不变,有氢气放出 | |
| B. | 已知钡的活动性处于钾和钠之间,则在溶液中钡离子可氧化金属锌,使之成为锌离子 | |
| C. | 研究小组通过实验探究Cu及其化合物的性质,将铜丝插入浓硫酸中并加热,反应后再加入水,观察硫酸铜溶液的颜色 | |
| D. | 次氯酸钠是漂粉精的主要成分 |
分析 A.钠和水反应生成氢氧化钠和氢气,消耗水,饱和的氢氧化钠溶液中有NaOH晶体析出,温度不变,氢氧化钠的溶解度不变;
B.钡与盐溶液反应先与水反应;
C.反应后的混合物与水混合的顺序错误;
D.次氯酸钠、氯化钠是漂粉精的主要成分;
解答 解:A.钠和水反应生成氢氧化钠和氢气,消耗水,饱和的氢氧化钠溶液中有NaOH晶体析出,温度不变,氢氧化钠的溶解度不变,溶液仍然是饱和溶液,浓度不变,所以pH值不变,故A正确;
B.金属性Ba>Zn,则在溶液中钡离子不能氧化金属锌,故B错误;
C.铜丝与浓硫酸加热生成硫酸铜后,再把混合物加入水中形成硫酸铜溶液,而不能把水加入反应混合物中,防止剩余的浓硫酸稀释时溅出,所以故C错误;
D.次氯酸钠、氯化钠是漂粉精的主要成分,次氯酸钠为有效成分,故D错误;
故选:A.
点评 本题考查金属的化学性质,明确Ba的化学性质处于K、Na之间是解答本题的关键,注意与Na的性质相比较来解答.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
16.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 16gO2中含有NA个氧原子 | |
| B. | 标准状况下,22.4L空气中含有NA个单质原子 | |
| C. | 分子数为NA的CO、N2混合气体的体积约为22.4L,质量为28g | |
| D. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol |
14.物质的分离与提纯是化学实验研究常用的方法.如表混合体系分离提纯对应的方法不正确的是( )
| 选项 | A | B | C | D |
| 混合体系 | 溴水 | 酒精与水 | 固体碘和氯化铵 | 混有少量KCl的KNO3粉末 |
| 分离方法 | 萃取、分液 | 加生石灰,蒸馏 | 加热 | 配成热的饱和溶液、降温结晶 |
| A. | A | B. | B | C. | C | D. | D |
1.NA为阿伏伽德罗常数的值.下列叙述错误的是( )
| A. | 标准状况下,22.4L CH3OH所含中子数为14NA | |
| B. | 常温常压下,1mol Na2CO3所含CO32-的数目等于NA | |
| C. | 56g Fe与足量水蒸气反应,转移的电子数目为$\frac{8}{3}$NA | |
| D. | 1L pH=0的H2SO4所含H+数目为NA |
11.下列物质在水溶液中的电离方程式不正确的是( )
| A. | Ca(OH)2═Ca2++2OH- | B. | Al2(SO4)3═2Al3++3SO42- | ||
| C. | NH4Cl═NH3+H++OH- | D. | HNO3═H++NO3- |
18.FeCl3溶液、Fe(OH)3胶体、Fe(OH)3浊液是三种重要的分散系,下列叙述中不正确的是( )
| A. | Fe(OH)3胶体区别于其他分散系的本质特征是分散质粒子的直径在10-9~10-7米之间 | |
| B. | 分别用一束光透过三种分散系,只有Fe(OH)3胶体具有丁达尔效应 | |
| C. | 三种分散系的颜色都相同,且均能与盐酸反应,具有吸附性 | |
| D. | 三种分散系中分散质均属于电解质 |
15.用惰性电极电解饱和Na2SO4溶液,若保持温度不变,电解一段时间后,下列有关说法正确的是( )
| A. | 溶液的pH变大 | |
| B. | c(Na+)与c(SO42-)的比值不变 | |
| C. | 电解过程中,向阳极附近溶液滴入酚酞,溶液变为红色 | |
| D. | 阴、阳极产生气体在相同条件下体积之比为1:2 |
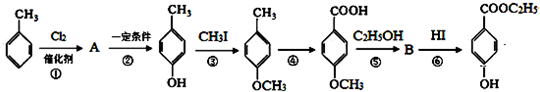
 .
.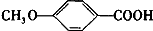 +C2H5OH$?_{△}^{浓硫酸}$
+C2H5OH$?_{△}^{浓硫酸}$ +H2O.
+H2O.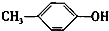 +CH2I→
+CH2I→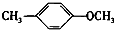 +HI.
+HI.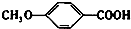 的同分异构体有多种,其中既含有酚羟基又含有酯基的同分异构体共有19种.
的同分异构体有多种,其中既含有酚羟基又含有酯基的同分异构体共有19种.