题目内容
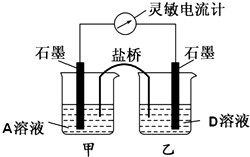 四种强电解质A、B、C、D的溶液,分别含有下列阴阳离子的各一种,且不重复.已知A溶液为黄色,含0.01mol的A溶液与含0.01mol的B溶液反应生成白色沉淀,再逐滴加入D溶液,白色沉淀最后转变为黄色沉淀.将C溶液滴在pH试纸的中部,显蓝色.
四种强电解质A、B、C、D的溶液,分别含有下列阴阳离子的各一种,且不重复.已知A溶液为黄色,含0.01mol的A溶液与含0.01mol的B溶液反应生成白色沉淀,再逐滴加入D溶液,白色沉淀最后转变为黄色沉淀.将C溶液滴在pH试纸的中部,显蓝色.| 阳离子 | K+、Fe3+、Ag+、Ca2+ |
| 阴离子 | Cl-、I-、CO32-、NO-3 |
(1)D的电子式为:
(2)C溶液中的离子浓度由大到小的顺序为:
(3)白色沉淀转变为黄色沉淀的离子方程式为:
(4)25℃时,在100mL 0.1mol/L的A溶液中,通入NH3,当溶液的pH=3时,A的金属离子全部沉淀.计算该沉淀的Ksp=
(5)加热固体B可分解为金属单质与两种气体,且一种为红棕色.则1mol B分解,转移的电子数为
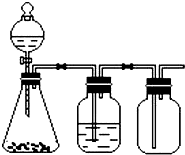
(6)控制适合的反应条件,A溶液与D溶液反应可设计成如图所示的装置.则该装置为
考点:常见阳离子的检验,原电池和电解池的工作原理,常见阴离子的检验
专题:物质检验鉴别题,电化学专题
分析:A溶液显黄色,故A中含有Fe3+,故A只能是氯化铁或者硝酸铁;黄色沉淀为AgI,而Ag只能与硝酸根结合才能溶解与水,故A是氯化铁,B是硝酸银,D中含有碘离子,为碘化钙,C可以使pH试纸显蓝色,故是碳酸钾,据此解答即可.
解答:
解:(1)依据分析得出D为CaI2,是离子化合物,故答案为: ;
;
(2)碳酸钾中存在电离:K2CO3=2K++CO 32-,故钾离子浓度大于碳酸根浓度;碳酸根属于弱酸根离子,存在水解反应:CO32-+H2O?HCO3-+OH-,但是水解程度很小,故碳酸根浓度大于碳酸氢根浓度,故离子浓度关系为:c (K+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故答案为c (K+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
(3)白色沉淀为AgCl,黄色沉淀为AgI,方程式为:AgCl(s)+I-=AgI(s)+Cl-,故答案为:AgCl(s)+I-=AgI(s)+Cl-;
(4)Fe(OH)3(s)?Fe3++3OH-,依据离子的浓度为1.0×10-5mol/L时认为沉淀完全,故Ksp=c(Fe3+)?c3(OH-)=1×10-5×(10-11)3=1.0×10-38,故答案为:1.0×10-38;
(5)硝酸银加热分解产生二氧化氮、氧气和银,即2AgNO3
2Ag+2NO2↑+O2↑,故2molB反应转移的电子数为1×4=4mol;即1molB分解,转移电子数2NA,故答案为:2NA;
(6)氯化铁与碘化钙能发生氧化还原反应,故能设计成原电池,乙烧杯中为碘化钙,故反应为:2I--2e-=I2,故答案为:2I--2e-=I2.
 ;
;(2)碳酸钾中存在电离:K2CO3=2K++CO 32-,故钾离子浓度大于碳酸根浓度;碳酸根属于弱酸根离子,存在水解反应:CO32-+H2O?HCO3-+OH-,但是水解程度很小,故碳酸根浓度大于碳酸氢根浓度,故离子浓度关系为:c (K+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故答案为c (K+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
(3)白色沉淀为AgCl,黄色沉淀为AgI,方程式为:AgCl(s)+I-=AgI(s)+Cl-,故答案为:AgCl(s)+I-=AgI(s)+Cl-;
(4)Fe(OH)3(s)?Fe3++3OH-,依据离子的浓度为1.0×10-5mol/L时认为沉淀完全,故Ksp=c(Fe3+)?c3(OH-)=1×10-5×(10-11)3=1.0×10-38,故答案为:1.0×10-38;
(5)硝酸银加热分解产生二氧化氮、氧气和银,即2AgNO3
| ||
(6)氯化铁与碘化钙能发生氧化还原反应,故能设计成原电池,乙烧杯中为碘化钙,故反应为:2I--2e-=I2,故答案为:2I--2e-=I2.
点评:本题主要考查的是物质的推断、电子式的书写、盐类水解以及离子浓度的大小判断、原电池原理等,综合性较强,属于中等题.

练习册系列答案
相关题目
下列各组物质的分类正确的是( )
①混合物:氯水、氨水、水玻璃、水银、福尔马林、聚乙烯
②电解质:明矾、冰醋酸、石膏、纯碱
③共价化合物:CO2、CC14、CH3CH3、NH4NO3
④同位素:1 H+、2H2、3H
⑤同素异形体:C60、C80、金刚石、石墨
⑥同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
⑦同分异构体:乙二酸二乙酯、乙二酸乙二酯.
①混合物:氯水、氨水、水玻璃、水银、福尔马林、聚乙烯
②电解质:明矾、冰醋酸、石膏、纯碱
③共价化合物:CO2、CC14、CH3CH3、NH4NO3
④同位素:1 H+、2H2、3H
⑤同素异形体:C60、C80、金刚石、石墨
⑥同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
⑦同分异构体:乙二酸二乙酯、乙二酸乙二酯.
| A、②⑤ | B、②④⑤⑦ |
| C、②⑤⑥⑦ | D、全部正确 |
 利用下列装置可以完成的实验组合是( )
利用下列装置可以完成的实验组合是( )
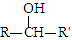 (R、R′表示烃基)
(R、R′表示烃基)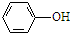
 +2H2C=CH2
+2H2C=CH2