题目内容
19.聚合氯化铝(化学式为[Al2(OH)nCl6-n•XH2O]m)晶体是一种高效无机水处理剂,如图是实验室模拟工业制备聚合氯化铝晶体的工艺流程,制备原料主要是铝加工行业的废渣铝灰,主要含Al2O3、Al,含有SiO2等杂质.
(1)试剂X(写名称)是氧化铝或氢氧化铝,操作2包含过滤、洗涤和干燥.
(2)生产过程中操作1的操作步骤沿玻璃棒慢慢向过滤器中注入溶液,待溶液滤出后,重复操作2到3次,至滤液澄清为止.
(3)当n=1时,制备Al2(OH)nCl6-n•XH2O的离子方程式:2nAl3++(6-n)Cl-+(x+n)H2O?Al2(OH)nCl6-n•XH2O+nH+.生产中要严格控制溶液中pH,过小,则氯化铝水解不完全,且n值偏小,产品产量质量会降低.而pH过大,产量也会降低,其原因是AlCl3完全水解为Al(OH)3,pH更大时还可将其溶解为[Al(OH)4]-.
(4)工业上采用电解装置制取活泼金属铝,若阳极产生的氧气全部与石墨电极反应生成CO和CO2气体,若生产中每生成8.1gAl,阳极损失石墨3.0g,则理论上产生CO的物质的量是0.05mol.
分析 向水中加入铝灰,铝灰中可溶性杂质被溶解,然后加入稀盐酸并加热搅拌,Al2O3、Al溶解,发生的反应方程式为2Al+6HCl=2AlCl3+3H2↑、Al2O3+6HCl=2AlCl3+3H2O,SiO2不溶于稀盐酸,难溶性固体和溶液采用过滤方法分离,将得到的滤液降温熟化,向溶液中加入X,调节溶液的pH到4.0-4.5之间,加入的X能和酸反应且不能引进新的杂质,最后将溶液过滤、洗涤、干燥得到较纯净的聚合氯化铝(化学式为[Al2(OH)nCl6-n•XH2O]m)晶体,
(1)加入的X能和酸反应且不能引进新的杂质;操作2包含过滤、洗涤和干燥;
(2)操作1为过滤,操作过程中要用玻璃棒引流,并重复过滤2-3次;
(3)当n=1时,氯离子、铝离子和水反应生成Al2(OH)Cl5•XH2O;
pH过大,铝离子水解生成Al(OH)3,Al(OH)3具有两性,能溶于强碱溶液;
(4)电解时,阳极上C失电子发生氧化反应、阴极上铝离子得电子发生还原反应,若生产中每生成8.1gAl,转移电子物质的量=$\frac{8.1g}{27g/mol}×3$=0.9mol,串联电路中转移电子相等,所以阳极上失去0.9mol电子,且阳极损失石墨3.0g,物质的量=$\frac{3.0g}{12g/mol}$=0.25mol,(
根据C原子守恒、转移电子守恒计算理论上产生n(CO).
解答 解:向水中加入铝灰,铝灰中可溶性杂质被溶解,然后加入稀盐酸并加热搅拌,Al2O3、Al溶解,发生的反应方程式为2Al+6HCl=2AlCl3+3H2↑、Al2O3+6HCl=2AlCl3+3H2O,SiO2不溶于稀盐酸,难溶性固体和溶液采用过滤方法分离,将得到的滤液降温熟化,向溶液中加入X,调节溶液的pH到4.0-4.5之间,加入的X能和酸反应且不能引进新的杂质,最后将溶液过滤、洗涤、干燥得到较纯净的聚合氯化铝(化学式为[Al2(OH)nCl6-n•XH2O]m)晶体,
(1)加入的X能和酸反应且不能引进新的杂质,则应该为氧化铝或氢氧化铝;操作2包含过滤、洗涤和干燥,
故答案为:氧化铝或氢氧化铝;洗涤;
(2)操作1为过滤,操作过程中要用玻璃棒引流,并重复过滤2-3次,其操作步骤为沿玻璃棒慢慢向过滤器中注入溶液,待溶液滤出后,重复操作2到3次,至滤液澄清为止,
故答案为:沿玻璃棒慢慢向过滤器中注入溶液,待溶液滤出后,重复操作2到3次,至滤液澄清为止;
(3)当n=1时,氯离子、铝离子和水反应生成Al2(OH)Cl5•XH2O,离子方程式为2nAl3++(6-n)Cl-+(x+n)H2O?Al2(OH)nCl6-n•XH2O+n H+;
pH过大,铝离子水解生成Al(OH)3,Al(OH)3具有两性,能溶于强碱溶液,所以pH再大时,Al(OH)3溶于溶液生成偏铝酸盐;
故答案为:2nAl3++(6-n)Cl-+(x+n)H2O?Al2(OH)nCl6-n•XH2O+nH+;
AlCl3完全水解为Al(OH)3,pH更大时还可将其溶解为[Al(OH)4]-;
(4)电解时,阳极上C失电子发生氧化反应、阴极上铝离子得电子发生还原反应,若生产中每生成8.1gAl,转移电子物质的量=$\frac{8.1g}{27g/mol}×3$=0.9mol,串联电路中转移电子相等,所以阳极上失去0.9mol电子,且阳极损失石墨3.0g,物质的量=$\frac{3.0g}{12g/mol}$=0.25mol,
设CO的物质的量为xmol,根据C原子守恒得n(CO2)=n(C)-n(CO)=0.25mol-xmol,根据转移电子守恒得xmol×(2-0)+(0.25-x)mol×(4-0)=0.9mol,x=0.05,
故答案为:0.05 mol.
点评 本题考查物质分离和提纯,为高频考点,侧重考查学生知识综合能力,涉及物质的量的计算、电解原理、盐类水解、基本操作等知识点,明确流程图中各个过程发生的反应及操作步骤是解本题关键,难点是(4)题计算,根据原子守恒、转移电子守恒解答即可,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 2、8、8 | B. | 8、8、18 | C. | 2、8、18 | D. | 8、18、18 |
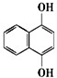 A苯环上的n溴代物的同分异构体的数目和m溴代物的同分异构体的数目相等,则n和m一定满足的关系式是( )
A苯环上的n溴代物的同分异构体的数目和m溴代物的同分异构体的数目相等,则n和m一定满足的关系式是( )| A. | 2n=m | B. | n=m | C. | n+m=6 | D. | n+m=8 |
(1)试剂:a.浓硫酸 b.氢氧化钠 c.生石灰 d.水 e.浓溴水
(2)方法:A.过滤 B.分液 C.蒸馏 D.洗气
| 要提纯的物质(杂质) | CH3CH2Br (C2H5OH) | C2H5OH (H2O) | CH4 (HCHO) | C6H5Br (Br2) | C6H6 (C6H5OH) |
| 选用试剂(1) | |||||
| 分离方法(2) |
 草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产.一种制备草酸晶体(H2C2O4•2H2O)的工艺流程如图:
草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产.一种制备草酸晶体(H2C2O4•2H2O)的工艺流程如图:
 .
.
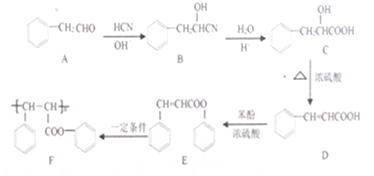
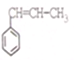 系统命名为1-苯基丙烯,则D的名称(系统命名)是3-苯基丙烯酸.
系统命名为1-苯基丙烯,则D的名称(系统命名)是3-苯基丙烯酸.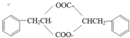 ;其在相同条件下还可能生成一种高聚酯类化合物,写出该反应的化学方程式
;其在相同条件下还可能生成一种高聚酯类化合物,写出该反应的化学方程式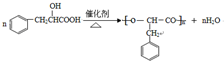 .
.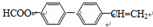 .
.