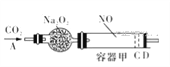
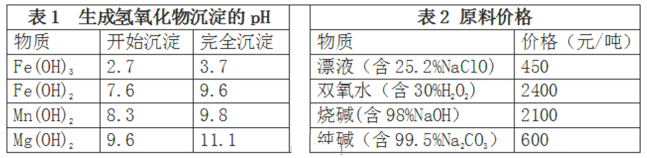
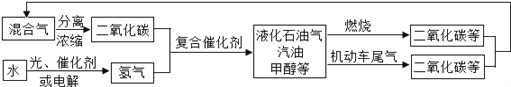
题目内容
【题目】某二元酸在水中的电离方程式为:H2B=H++HB-; HB-![]() H++B2-。回答下列问题:
H++B2-。回答下列问题:
(1)Na2B 溶液显__________(填“酸性、中性、或碱性”),理由是(用离子方程式表示):____________________________________________。
(2)在0.1mol/L 的Na2B 溶液中,下列粒子浓度关系正确的是__________。
A.c(B2-)+c(HB–)+c(H2B)=0.1 mol/L
B.c(Na+)+ c(H+)= c(HB–)+c(OH–) +2c(B2-)
C.c(Na+)=2c(HB–) +2c(B2-)
D. c(H+)=c(OH–)-c(HB–)-2c(H2B)
(3)已知0.1 mol/LNaHB溶液的pH=2,则0.1 mol/LH2B溶液中c(H+)可能是_____0.11mol/L(填“<”、“>”或“=”),理由是_______________________。
(4)0.1mol/LNaHB溶液中各种离子浓度大小为_________________________。
【答案】 碱性 B2-+H2O![]() HB-+OH- BC < H2B第一步电离产生的H+,抑制了HB-的电离 c(Na+)>c(HB–) >c(H+)>c(B2–)>c(OH–)
HB-+OH- BC < H2B第一步电离产生的H+,抑制了HB-的电离 c(Na+)>c(HB–) >c(H+)>c(B2–)>c(OH–)
【解析】本题主要考查弱酸电离及盐类水解。
(1)Na2B溶液显碱性,理由是(用离子方程式表示)B2-+H2O![]() HB-+OH-。
HB-+OH-。
(2)A.溶液中不存在H2B,故A错误;B.电荷守恒:c(Na+)+ c(H+)= c(HB–)+c(OH–) +2c(B2-),故B正确;C.从Na2B的组成比可得c(Na+)=2c(HB–) +2c(B2-),故C正确;D. 溶液中不存在H2B,故D错误。故选BC。
(3)已知0.1 mol/LNaHB溶液的pH=2,则0.1mol/LH2B溶液中c(H+)可能是<0.11mol/L,理由是H2B第一步电离产生的H+,抑制了HB-的电离。
(4)0.1mol/LNaHB溶液中pH=2表明HB-的电离程度大于水解程度,各种离子浓度大小为c(Na+)>c(HB–) >c(H+)>c(B2–)>c(OH–)。

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案