题目内容
7.实现下列有机化合物转化的最佳方法是( )
| A. | 与足量NaOH溶液共热后再通入足量稀硫酸 | |
| B. | 与足量NaOH溶液共热后再通入足量CO2 | |
| C. | 与足量稀硫酸共热后再加入足量NaHCO3溶液 | |
| D. | 与足量稀硫酸共热后再加入足量NaOH溶液 |
分析  ,应先在碱性条件下水解生成
,应先在碱性条件下水解生成 ,由于
,由于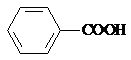
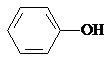

 ,然后加入碳酸氢钠溶液可生成
,然后加入碳酸氢钠溶液可生成
解答 解:A.与足量的NaOH溶液共热后,水解生成 ,再加入适量H2SO4,生成
,再加入适量H2SO4,生成 ,得不到所需物质,故A错误;
,得不到所需物质,故A错误;
B.碱性条件下水解生成 ,通入二氧化碳气体可生成
,通入二氧化碳气体可生成
C.在酸性条件下水解生成 ,再加入足量的NaHCO3溶液,-COOH与之反应,反应生成
,再加入足量的NaHCO3溶液,-COOH与之反应,反应生成
D.在酸性条件下水解生成 ,加入NaOH后生成
,加入NaOH后生成 ,得不到
,得不到
故选BC.
点评 本题考查有机物的结构和性质,为高频考点,侧重考查学生的分析能力,注意把握有机物官能团的性质,本题特别注意有机物的官能团的酸性强弱,把握反应的可能性,难度不大.

练习册系列答案
相关题目
14. LiOH常用于制备锂离子电池正极材料.工业上常利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.下列说法正确的是( )
LiOH常用于制备锂离子电池正极材料.工业上常利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.下列说法正确的是( )
 LiOH常用于制备锂离子电池正极材料.工业上常利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.下列说法正确的是( )
LiOH常用于制备锂离子电池正极材料.工业上常利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.下列说法正确的是( )| A. | a是电源的负极 | |
| B. | B极区电解液为LiOH溶液 | |
| C. | A电极的电极反应式为4OH--4e-═2H2O+O2↑ | |
| D. | 外电路中每通过0.1 mol电子,生成1.12 L氢气 |
18. 一定条件下,体积为10L的固定容器发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应过程如图:下列说法正确的是( )
一定条件下,体积为10L的固定容器发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应过程如图:下列说法正确的是( )
 一定条件下,体积为10L的固定容器发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应过程如图:下列说法正确的是( )
一定条件下,体积为10L的固定容器发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应过程如图:下列说法正确的是( )| A. | t1min时正、逆反应速率相等 | |
| B. | X曲线表示NH3的物质的量随时间变化的关系 | |
| C. | 0~8 min,H2的平均反应速率 v(H2)=0.075mol•L-1•min-1 | |
| D. | 10~12 min,升高温度使反应速率加快,平衡正向移动 |
15.下列属于碱性氧化物的是( )
| A. | K2CO3 | B. | Na2O2 | C. | Mn2O7 | D. | MgO |
2.下列元素性质的递变规律正确的是( )
| A. | 原子半径:C<N<S | B. | 第一电离能:Na<Mg<Al | ||
| C. | 电负性:P<N<O | D. | 气态氢化物的稳定性:NH3<H2O<H2S |
19.向AgCl饱和溶液中加水,下列叙述正确的是( )
| A. | 溶解度.Ksp均不变 | |
| B. | 溶解度.Ksp均变大 | |
| C. | 结晶过程停止,溶解过程加快 | |
| D. | 结晶过程将小于溶解过程,直至再达到平衡 |
16.标准状况下,6.72LNO2通入水中后,收集到5.04L气体,则被氧化的NO2的体积是( )
| A. | 1.12L | B. | 2.24L | C. | 0.56L | D. | 1.68L |
17.下列实验操作、现象和结论均正确,且存在对应关系的是( )
| 选项 | 实验操作 | 实验象 | 结论 |
| A | 将AlCl3溶液逐滴加NaOH溶液中 | 先无现象后产生白色胶状沉淀 | Al(OH)3是两性氢氧化物 |
| B | 向2支盛有醋酸和硼酸溶液的管中分别滴加Na2CO3溶液 | 醋酸:产生气泡; 硼酸:无现象 | Ka(CH3COOH)>Ka1(H2CO3)>Ka(H3BO3) |
| C | 将少量MgCl2溶液加入Fe(OH)3悬浊液中,振荡静置 | 沉淀由红褐色变为白色 | Fe(OH)3的溶解度大于Mg(OH)2 |
| D | 溴乙烷、乙醇及固体NaOH混合加热,产生的气态物质通入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | 溴乙烷发生消去反应生成了乙烯 |
| A. | A | B. | B | C. | C | D. | D |