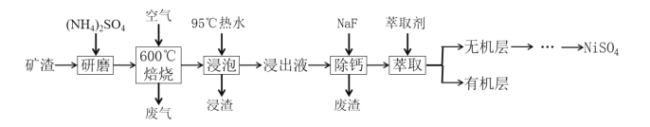
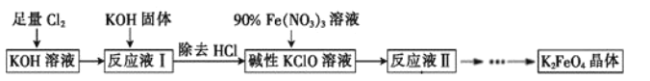
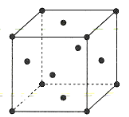
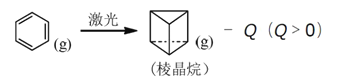
题目内容
【题目】常温下,向20mL0.1mol·L-1NaHC2O4溶液中缓慢滴加pH=13的NaOH溶液,混合溶液的温度与滴加NaOH溶液体积的关系如图所示。下列说法错误的是( )
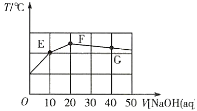
A.E点存在:2c(Na+)=3c(H2C2O4)+3c(HC2O4-)+3c(C2O42-)
B.F点存在:c(OH-)>c(H+)+c(HC2O4-)+c(H2C2O4)
C.在E、F和G点中,G点对应的Kw最小
D.G点对应的溶液中,c(Na+)>c(OH-)>c(C2O42-)>c(HC2O4-)
【答案】C
【解析】
A.E点加入10mL等浓度的NaOH溶液,反应后溶质为等浓度的NaHC2O4和Na2C2O4,根据物料守恒可得:2c(Na+)=3c(H2C2O4)+3c(HC2O4-)+3c(C2O42-),故A正确;
B.F点温度最高,说明NaHC2O4与NaOH恰好完全反应,反应后溶质为Na2C2O4,根据溶液Na2C2O4中的质子守恒可得:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4),所以c(OH-)>c(H+)+c(HC2O4-)+c(H2C2O4),故B正确;
C.根据图象可知,E、F和G点的温度:F>G>E,温度升高水的离子积增大,则E点水的离子积最小,故C错误;
D.G点加入40mL等浓度的NaOH溶液,反应后溶质为等浓度的NaOH和Na2C2O4,Na+的浓度最大,C2O42部分水解,则c(OH)>c(C2O42),溶液中离子浓度大小为:c(Na+)>c(OH-)>c(C2O42-)>c(HC2O4-),故D正确;
答案选C。

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】表为元素周期表的一部分,表中a~f代表六种短周期主族元素。完成下列填空:
a | b | c |
d | e | f |
(1)六种元素中,原子半径最大的是_________ (填元素编号) 。d、e、f三种元素的原子结构上的相同点是________________________________。
(2)若a的气态氢化物的水溶液呈碱性,则a的气态氢化物的电子式是___________;六种元素中,最高价氧化物对应水化物的酸性最强的是_________(填元素符号)。
(3)若f元素的原子L层电子数比M层电子数多1个,则e元素的非金属性比f元素的非金属性_________(选填“强”、“弱’’),能说明这一事实的化学方程式是____________________(任写一个)。
(4)若b为非金属元素,则以下推断正确的是_________(选填编号)。
①a一定是金属元素 ②d一定是金属元素 ③f一定是非金属元素
【题目】某实验小组利用如图装置,测定某种旧铝合金(含Al2O3和其它不溶于NaOH溶液的成分)中Al的质量分数,其中100mLNaOH溶液过量,每隔相同时间读得电子天平的数据如表:
称量对象 | 读数次数 | 质量(g) |
样品 | 第1次 | 2.582 |
锥形瓶+100mL NaOH溶液 | 第2次 | 185.721 |
锥形瓶+NaOH溶液+样品 | 第3次 | 188. 286 |
第4次 | 188. 254 | |
第5次 | 188. 243 | |
第6次 | 188. 243 |
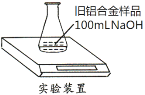
(1)反应的化学方程式为_____________________________________________________、__________________________________________________。
(2)反应中产生的H2质量为___________________ g。
(3)样品中Al的质量分数为___________________(用小数表示,小数点后保留两位)。该小组为了测定其中Al2O3的含量,从上面反应后的100mL溶液中,取出10mL溶液,逐滴加入1mol/L的盐酸,当滴到5.00mL时开始产生沉淀,继续滴加盐酸,至25.00mL时沉淀恰好全部溶解。
(4)取出的10mL溶液中,AlO2-的物质的量浓度为_____________________________;
(5)Al2O3的质量分数_____________________(用小数表示,小数点后保留两位)。