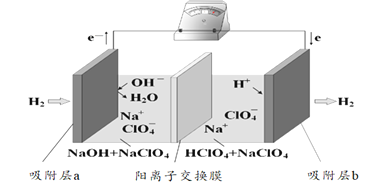
题目内容
【题目】从某矿渣(成分为NiFe2O4、NiO、FeO、CaO、SiO2等)中回收NiSO4的工艺流程如图:
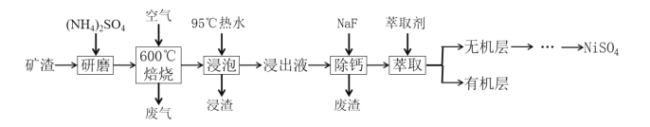
已知①600℃时发生反应:NiFe2O4+4H2SO4═NiSO4+Fe2(SO4)3+4H2O
②Ksp(CaF2)=4.0×10-11
回答下列问题:
(1)将NiFe2O4写成氧化物的形式为__;(NH4)2SO4的作用是__。
(2)“焙烧”时矿渣中部分FeO反应生成Fe2(SO4)3的化学方程式为__。
(3)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有__(写化学式)。
(4)向“浸出液”中加入NaF以除去Ca2+,当溶液中c(F-)=2.0×10-3molL-1时,若除钙率为99%,则原“浸出液”中c(Ca2+)=__gL-1。
(5)“萃取”后,分离得到无机层的操作为__,用到的主要玻璃仪器是__。
(6)将“浸渣”进一步处理后,利用以下流程可得到高铁酸盐。K2FeO4是倍受关注的一类新型、高效、无毒的多功能水处理剂。回答下列问题:
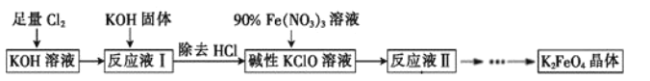
①反应液Ⅰ和90%Fe(NO3)3溶液反应的离子方程式为__。
②反应液Ⅱ经过蒸发浓缩、冷却结晶、过滤可得到K2FeO4晶体,流程中的碱用KOH而不用NaOH的原因是__。
【答案】NiOFe2O3 提供和矿渣反应的硫酸(或硫酸铵分解产生硫酸等) 4FeO+6H2SO4+O2![]() 2Fe2(SO4)3+6H2O SiO2 4.0×10-2 分液 分液漏斗 2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2 高铁酸根在苛性钠溶液中的溶解度大于苛性钾溶液
2Fe2(SO4)3+6H2O SiO2 4.0×10-2 分液 分液漏斗 2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2 高铁酸根在苛性钠溶液中的溶解度大于苛性钾溶液
【解析】
某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,加入硫酸铵研磨后,600°C焙烧,已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4.NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3,在90°C的热水中浸泡过滤得到浸出液,加入NaF除去钙离子,过滤得到滤液加入萃取剂得到无机相和有机相,无机相通过一系列操作得到硫酸镍,有机相循环使用;
足量Cl2通入和KOH溶液中,温度低时发生反应Cl2+2OH-=Cl-+ClO-+H2O,向溶液I中加入KOH,使氯气完全反应,且将溶液转化为碱性溶液,只有碱性条件下次氯酸根离子才能和铁离子发生氧化还原反应生成高铁酸根离子,除去KCl得到碱性的KClO浓溶液,向碱性的KClO浓溶液中加入90%的Fe(NO3)3溶液,发生反应2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,得到溶液II,纯化得到湿产品,将湿产品洗涤、干燥得到晶体K2FeO4。
(1)(NH4)2SO4的作用:提供和矿渣反应的硫酸(或硫酸铵分解产生硫酸等),故答案为:NiOFe2O3;提供和矿渣反应的硫酸(或硫酸铵分解产生硫酸等);
(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为4FeO+6H2SO4+O2![]() 2Fe2(SO4)3+6H2O,故答案为:4FeO+6H2SO4+O2
2Fe2(SO4)3+6H2O,故答案为:4FeO+6H2SO4+O2![]() 2Fe2(SO4)3+6H2O;
2Fe2(SO4)3+6H2O;
(3)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有SiO2,故答案为:SiO2;
(4)当溶液中c(F-)=2.0×10-3molL-1时,c(Ca2+)=![]() molL-1=1.0×10-5molL-1,原“浸出液”中c(Ca2+)为x,除钙率为
molL-1=1.0×10-5molL-1,原“浸出液”中c(Ca2+)为x,除钙率为![]() ×100%=99%,x=1.0×10-3mol/L=(1.0×10-3mol×40g/mol)/L=4.0×10-2gL-1
×100%=99%,x=1.0×10-3mol/L=(1.0×10-3mol×40g/mol)/L=4.0×10-2gL-1
故答案为:4.0×10-2;
(5)“萃取”后,分离得到无机层的操作是分液,主要仪器是分液漏斗,故答案为:分液;分液漏斗;
(6)①反应液Ⅰ和90%Fe(NO3)3溶液反应的离子方程式为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
②足量的氯气与KOH反应得到“反应液I”,“反应液I”中含有过量的氯气,在“反应液I”中加KOH固体可以与“反应液I”中过量的Cl2继续反应,生成更多的KClO,反应液Ⅱ经过蒸发浓缩、冷却结晶、过滤可得到K2FeO4晶体,流程中的碱用KOH而不用NaOH的原因是:高铁酸根在苛性钠溶液中的溶解度大于苛性钾溶液,故答案为:高铁酸根在苛性钠溶液中的溶解度大于苛性钾溶液。

 备战中考寒假系列答案
备战中考寒假系列答案