题目内容
(1)写出铝单质与氢氧化钠溶液反应的离子方程式 ;写出AlCl3与氨水反应的离子方程式 .
(2)500mL 0.2mol/L的AlCl3溶液,当滴加100mL 2mol/L的NaOH溶液时,生成的沉淀 克,当再滴加80mL该NaOH溶液时,此时溶液中有 克沉淀.
(2)500mL 0.2mol/L的AlCl3溶液,当滴加100mL 2mol/L的NaOH溶液时,生成的沉淀
考点:铝的化学性质,离子方程式的书写,化学方程式的有关计算
专题:几种重要的金属及其化合物
分析:(1)铝单质与氢氧化钠溶液反应生成四羟基合铝酸钠和氢气,AlCl3与氨水反应生成氢氧化铝沉淀,一水合氨为弱电解质,保留化学式;
(2)氯化铝中滴加强氧化钠溶液依次发生反应:AlCl3+3NaOH=Al(OH)3↓+3NaCl;Al(OH)3+NaOH=Na[Al(OH)4]据此解答.
(2)氯化铝中滴加强氧化钠溶液依次发生反应:AlCl3+3NaOH=Al(OH)3↓+3NaCl;Al(OH)3+NaOH=Na[Al(OH)4]据此解答.
解答:
解:(1)铝单质与氢氧化钠溶液反应生成四羟基合铝酸钠和氢气,反应的离子方程式为2Al+2OH-+6H2O=[Al(OH)4]-+3H2↑;AlCl3与氨水反应的离子方程式为:Al3++3NH3.H2O=Al(OH)3+3NH+,
故答案为:2Al+2OH-+6H2O=[Al(OH)4]-+3H2↑;Al3++3NH3.H2O=Al(OH)3+3NH4+;
(2)氯化铝的物质的量为:0.5L×0.2mol/L=0.1mol,当滴加100mL 2mol/L的NaOH溶液时NaOH的物质的量为:0.1L×2mol/L=0.2mol,依据方程式:
AlCl3+3NaOH=Al(OH)3↓+3NaCl
1 3 1
0.1mol 0.2mol n
可知氢氧化钠不足,产生氢氧化铝沉淀的量应该依据氢氧化钠的量结算,所以产生的氢氧化铝的物质的量为=
,质量为:
×78g/mol=5.2g;
当再滴加80mL该NaOH溶液时,共加入氢氧化钠的物质的量为:0.18L×2mol/L=0.36mol,依据方程式:
AlCl3+3NaOH=Al(OH)3↓+3NaCl
1 3 1
0.1mol 0.36mol n
0.1mol 0.3mol 0.1mol
可知氢氧化钠过量,产生沉淀的量应依据氯化铝的物质的量计算,所以产生的氢氧化铝的物质的量为=0.1mol,消耗氢氧化钠的物质的量为0.3mol,
强氧化铝能与强碱发生反应:Al(OH)3+NaOH=Na[Al(OH)4],依据方程式:
Al(OH)3+NaOH=Na[Al(OH)4]
1 1
0.1mol (0.36-0.3)mol
对该反应,氢氧化钠不足,反应掉的氢氧化铝的物质的量应该依据氢氧化钠的量计算,所以溶解的氢氧化铝的物质的量为:0.06mol,则剩余的氢氧化铝的物质的量为:0.1mol-0.06mol=0.04mol,其质量为:0.04mol×78g/mol=3.12g,
故答案为:5.2;3.12.
故答案为:2Al+2OH-+6H2O=[Al(OH)4]-+3H2↑;Al3++3NH3.H2O=Al(OH)3+3NH4+;
(2)氯化铝的物质的量为:0.5L×0.2mol/L=0.1mol,当滴加100mL 2mol/L的NaOH溶液时NaOH的物质的量为:0.1L×2mol/L=0.2mol,依据方程式:
AlCl3+3NaOH=Al(OH)3↓+3NaCl
1 3 1
0.1mol 0.2mol n
可知氢氧化钠不足,产生氢氧化铝沉淀的量应该依据氢氧化钠的量结算,所以产生的氢氧化铝的物质的量为=
| 0.2mol |
| 3 |
| 0.2mol |
| 3 |
当再滴加80mL该NaOH溶液时,共加入氢氧化钠的物质的量为:0.18L×2mol/L=0.36mol,依据方程式:
AlCl3+3NaOH=Al(OH)3↓+3NaCl
1 3 1
0.1mol 0.36mol n
0.1mol 0.3mol 0.1mol
可知氢氧化钠过量,产生沉淀的量应依据氯化铝的物质的量计算,所以产生的氢氧化铝的物质的量为=0.1mol,消耗氢氧化钠的物质的量为0.3mol,
强氧化铝能与强碱发生反应:Al(OH)3+NaOH=Na[Al(OH)4],依据方程式:
Al(OH)3+NaOH=Na[Al(OH)4]
1 1
0.1mol (0.36-0.3)mol
对该反应,氢氧化钠不足,反应掉的氢氧化铝的物质的量应该依据氢氧化钠的量计算,所以溶解的氢氧化铝的物质的量为:0.06mol,则剩余的氢氧化铝的物质的量为:0.1mol-0.06mol=0.04mol,其质量为:0.04mol×78g/mol=3.12g,
故答案为:5.2;3.12.
点评:本题考查了离子方程式的书写、铝的性质及相关计算,题目难度中等,(2)为易错点,明确氯化铝与氢氧化钠反应得到的产物与氢氧化钠的用量有关是解题关键.

练习册系列答案
相关题目
下列热化学方程式书写正确的是( )
| A、2SO2+O2?2SO2△H=-196.6KJ/mol |
| B、N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol |
| C、2H2(g)+O2(g)=2H2O(g)△H=+571.16KJ/mol |
| D、C(s)+CO2(g)?2CO(g)△H=+131KJ/mol |
 与它互为同分异的构体的有( )
与它互为同分异的构体的有( )
 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.
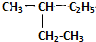 和
和

 如图所示,U形管内盛有100mL的溶液,请按要求回答下列回答.
如图所示,U形管内盛有100mL的溶液,请按要求回答下列回答.