题目内容
氨气与灼热的氧化铜反应生成铜、氮气和水.利用如图所示实验装置可测定氨分子的组成(图中夹持、固定装置均略去),回答下列问题.
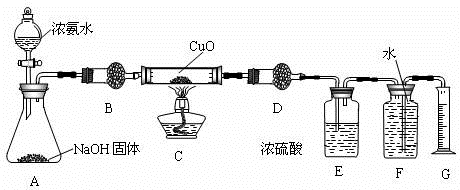
(1)A中放NaOH的目的是: ;
(2)在干燥管B和D里应选用的干燥剂都是(填序号) ;
A、碱石灰
B、无水CuSO4
C、五氧化二磷
D、无水CaCl2
(3)E装置中盛装浓硫酸的目的是 ;
(4)待实验完毕后,若实验测得N2的体积(折算成标准状况)为a L,则被还原的氧化铜的物质的量为 mol;若测得干燥管D增重b g,则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示) .
(5)上述实验中,如果省去B装置,测定氨分子组成的N、H原子个数的比值将会(填“增大”、“减小”或“无影响”) ,理由是 .

(1)A中放NaOH的目的是:
(2)在干燥管B和D里应选用的干燥剂都是(填序号)
A、碱石灰
B、无水CuSO4
C、五氧化二磷
D、无水CaCl2
(3)E装置中盛装浓硫酸的目的是
(4)待实验完毕后,若实验测得N2的体积(折算成标准状况)为a L,则被还原的氧化铜的物质的量为
(5)上述实验中,如果省去B装置,测定氨分子组成的N、H原子个数的比值将会(填“增大”、“减小”或“无影响”)
考点:氨的制取和性质
专题:实验设计题
分析:氨气与灼热的氧化铜反应生成铜、氮气和水,反应的化学方程式为:2NH3+3CuO
N2+3Cu+3H2O,
(1)根据氢氧化钠能够电离出氢氧根离子、氢氧化钠溶于水放出热量等方面分析;
(2)氨气为碱性气体,不能用酸性干燥剂干燥;
(3)浓硫酸能够吸收未反应的氨气,还能够防止F中水分进入D;
(4)根据n=
计算出氮气的物质的量,再根据反应方程式2NH3+3CuO
N2+3Cu+3H2O计算出被还原的氧化铜的物质的量;根据n=
计算出反应生成水的物质的量,再根据质量守恒定律计算出N、H原子数之比;
(5)根据测定的反应生成水的质量偏大分析对测定氨分子组成的N、H原子个数的比值的影响.
| ||
(1)根据氢氧化钠能够电离出氢氧根离子、氢氧化钠溶于水放出热量等方面分析;
(2)氨气为碱性气体,不能用酸性干燥剂干燥;
(3)浓硫酸能够吸收未反应的氨气,还能够防止F中水分进入D;
(4)根据n=
| V |
| Vm |
| ||
| m |
| M |
(5)根据测定的反应生成水的质量偏大分析对测定氨分子组成的N、H原子个数的比值的影响.
解答:
解:(1)浓氨水中存在平衡:NH3+H2O?NH3?H2O?NH4++OH-,氢氧化钠在溶液中电离出氢氧根离子,有利于氨气的生成;且氢氧化钠溶于水放出热量,降低了氨气的溶解度,
故答案为:利用NaOH的碱性和遇水放热的性质,使NH3?H2O分解生成NH3后逸出;
(2)无水硫酸铜只能用于检验水的存在,不能用于干燥氨气;五氧化二磷、无水氯化钙能够与氨气反应,不能干燥氨气,所以装置BD中盛放的是碱石灰,所以A正确,
故答案为:A;
(3)浓硫酸能够将反应剩余的氨吸收,防止F中的水蒸气进入D中,引起测量误差,
故答案为:吸收多余的NH3,防止F中的水蒸气进入D中;
(4)标准状况下,aL氮气的物质的量为:n(N2)=
=
mol,根据反应2NH3+3CuO
N2+3Cu+3H2O可知,被还原的CuO的物质的量为:n(CuO)=3n(N2)=
mol×3=
mol;
装置D增重的为水的质量,则水的物质的量为:
=
mol,含有的H的物质的量为:
mol×2=
mol,
氨气中含有的N、H原子数之比为:(
mol×2):
mol=
,
故答案为:
;
;
(5)因为由NH3带出的水蒸气进入D装置,导致H原子的个数增加,则测定氨分子组成的N、H原子个数的比值将会减小,
故答案为:减小;因为由NH3带出的水蒸气进入D装置,导致H原子的个数增加.
故答案为:利用NaOH的碱性和遇水放热的性质,使NH3?H2O分解生成NH3后逸出;
(2)无水硫酸铜只能用于检验水的存在,不能用于干燥氨气;五氧化二磷、无水氯化钙能够与氨气反应,不能干燥氨气,所以装置BD中盛放的是碱石灰,所以A正确,
故答案为:A;
(3)浓硫酸能够将反应剩余的氨吸收,防止F中的水蒸气进入D中,引起测量误差,
故答案为:吸收多余的NH3,防止F中的水蒸气进入D中;
(4)标准状况下,aL氮气的物质的量为:n(N2)=
| aL |
| 22.4L/mol |
| a |
| 22.4 |
| ||
| a |
| 22.4 |
| 3a |
| 22.4 |
装置D增重的为水的质量,则水的物质的量为:
| bg |
| 18g/mol |
| b |
| 18 |
| b |
| 18 |
| b |
| 9 |
氨气中含有的N、H原子数之比为:(
| a |
| 22.4 |
| b |
| 9 |
| 9a |
| 11.2b |
故答案为:
| 3a |
| 22.4 |
| 9a |
| 11.2b |
(5)因为由NH3带出的水蒸气进入D装置,导致H原子的个数增加,则测定氨分子组成的N、H原子个数的比值将会减小,
故答案为:减小;因为由NH3带出的水蒸气进入D装置,导致H原子的个数增加.
点评:本题考查了氨气的制法及化学性质,题目难度中等,注意掌握制取氨气的反应原理、氨气的化学性质,明确实验测定原理为解答本题的关键,(5)为易错点,需要明确装置BD的作用.

练习册系列答案
相关题目
2014南京青奥会,体操运动员在比赛时为了防滑.常在手掌上涂抹碳酸镁粉末,碳酸镁属于 ( )
| A、酸 | B、碱 | C、盐 | D、氧化物 |
下列实验操作能达到预期目的是( )
| A、向某无色溶液中加入BaCl2溶液产生不溶于稀HNO3的白色沉淀,说明原溶液中一定有SO42- |
| B、向某无色溶液中加入盐酸,有无色无味的气体产生,则说明原溶液中一定有CO32- |
| C、向某溶液中滴加KSCN溶液,溶液不变红,再滴加氯水,变红,说明原溶液一定有Fe2+ |
| D、将某溶液进行焰色反应时,火焰呈黄色,则溶液中一定无K+ |
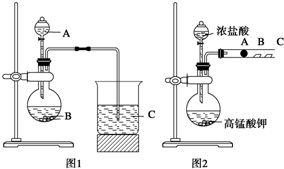 某研究性学习小组设计了一组实验来探究元素周期律.甲同学:根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;
某研究性学习小组设计了一组实验来探究元素周期律.甲同学:根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;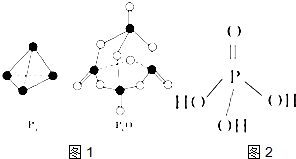 第五主族的磷单质及其化合物在工业上有广泛应用.
第五主族的磷单质及其化合物在工业上有广泛应用.