题目内容
9.同周期中A、B、C、D、E、F 依次增大的短周期元素.已知:A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应,均生成盐和水.请完成下列问题:(1)根据以上条件一定能判断出的元素有几种,请在下列横线上写出相应的元素符号:
A.Na,B.Mg,C.Al,D.P,E.S,F.Cl.
(2)已知D单质在F单质中燃烧可能生成两种化合物,请分别写出生成两种化合物的化学方程式:3Cl2+2P$\frac{\underline{\;点燃\;}}{\;}$2PCl3;5Cl2+2P$\frac{\underline{\;点燃\;}}{\;}$2PCl5.
(3)若1 mol F的最高价氧化物水化物与C的最高价氧化物水化物恰好完全反应,则等物质的量的C的最高价氧化物与A的最高价氧化物水化物反应消耗$\frac{1}{3}$mol A的最高价氧化物水化物.
分析 A、B、C、D、E、F为原子序数依次增大的短周期元素,A、C、F三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,应是两性氢氧化物与强酸、强碱的反应,结合原子序数可知:A为Na、C为Al,三种原子最外层共有11个电子,则F的最外层电子数为11-1-3=7,则F为Cl元素;B的原子序数介于Na和Al之间,所以B为Mg元素;已知D单质在F单质中燃烧可能生成两种化合物,D的原子序数介于Al和S之间,则D为P,结合原子序数大小可知E为S,据此进行解答.
解答 解:(1)A、B、C、D、E、F为原子序数依次增大的短周期元素,A、C、F三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,应是两性氢氧化物与强酸、强碱的反应,结合原子序数可知:A为Na、C为Al,三种原子最外层共有11个电子,则F的最外层电子数为11-1-3=7,则F为Cl元素;B的原子序数介于Na和Al之间,所以B为Mg元素;D、E的原子序数介于Al和Cl之间,则D为Si、E为P元素,
根据分析可知,A为Na、B为Mg、C为Al、D为P、E为S、F为Cl元素,
故答案为:Na;Mg;Al;P;S;Cl;
(2)F的单质氯气,磷与氯气反应生成三氯化磷、五氯化磷,反应的化学方程式为:3Cl2+2P$\frac{\underline{\;点燃\;}}{\;}$2PCl3、5Cl2+2P$\frac{\underline{\;点燃\;}}{\;}$2PCl5,
故答案为:3Cl2+2P$\frac{\underline{\;点燃\;}}{\;}$2PCl3;5Cl2+2P$\frac{\underline{\;点燃\;}}{\;}$2PCl5;
(3)F的最高价氧化物水化物为高氯酸,C的最高价氧化物水化物为氢氧化铝,A的最高价氧化物水化物为NaOH,
发生反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O、OH-+Al(OH)3=AlO2-+2H2O,
则1mol高氯酸完全反应消耗$\frac{1}{3}$mol氢氧化铝,$\frac{1}{3}$mol氢氧化铝完全反应消耗$\frac{1}{3}$molNaOH,
故答案为:$\frac{1}{3}$.
点评 本题考查了位置、结构与性质的关系,题目难度中等,正确推断各元素名称为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,明确常见物质性质及反应方程式.

| A. | 25℃时,1L pH=13的Ba(OH)2溶液中含有OH一的数目为0.2NA | |
| B. | 取50mL 14.0moI.L-l浓硝酸与足量的铜片反应,生成气体分子的数目为0.35NA | |
| C. | 标准状况下,2.24L二氧化硫中含有的电子总数为3.2NA | |
| D. | 28gN2与28g C18O中含有的质子数均为14 |
| A. | 向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ | |
| B. | 向硝酸银溶液中加入足量的氨水:Ag++2NH3•H2O═Ag(NH3)2++2H2O | |
| C. | 泡沫灭火器的灭火原理:2Al3++3CO32-+3H20═2Al(OH)3↓+3CO2↑ | |
| D. | 用足量的氨水处理硫酸工业的尾气:SO2+NH3•H2O═NH4++HSO3- |
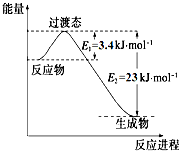 研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气.如图表示恒压容器中0.5mol CO2和1.5mol H2转化率达80%时的能量变化示意图. 能判断该反应达到化学平衡状态的依据是bd.
a.容器中压强不变
b.H2的体积分数不变c.
c(H2)=3c(CH3OH)
d.容中密度不变
e.2个C=O断裂的同时有6个H-H断裂.
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组[ | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值<1(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正<V逆(填“<”,“>”,“=”).
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol.
(4)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性.常温下,向10mL 0.01mol•L-1 H2C2O4溶液中滴加10mL 0.01mol•L-1NaOH溶液时,比较溶液中各种离子浓度的大小关系c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(5)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式为CH3OCH3+16OH--12e-=2CO32-+11H2O.
| A. | 某无色溶液中:NH4+、Na+、Cl-、MnO4- | |
| B. | 常温下由水电离出的c(H+)=1×10-13mol•L-1的溶液中:Na+、K+、SO32-、CO32- | |
| C. | 在c(H+)=1×10-13mol•L-1的溶液中:NH4+、Al3+、SO42-、NO3- | |
| D. | 在pH=1的溶液中:K+、Mg2+ SiO32- SO42- |
| A. | 石油裂解的主要目的是提高汽油等轻质油的产量与质量,石油催化裂化的主要目的是得到更多的乙烯、丙烯等气态短链烃 | |
| B. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| C. | 汽车尾气催化转化装置可将尾气中的NO和CO等有害气体转化为N2和CO2,该装置中的催化剂可降低NO和CO反应的活化能,有利于提高该反应的平衡转化率 | |
| D. | 近期在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |
| A. | 房屋装修所用装饰材料释放出的甲醛、苯、氨等气体对人体无害,不会造成污染 | |
| B. | 食品包装袋小包内盛有装氧化钙或生石灰用作食品的抗氧化剂 | |
| C. | 制作航天服的聚酯纤维和“天宫一号”中使用的碳纤维都是新型无机非金属材料 | |
| D. | 绿色化学的核心就是利用化学原理从源头减少和消除工业对环境的污染 |
 双氧水是一种对环境友好的消毒剂、漂白剂,广泛应用于化工、医药、环保等领域.请回答下列问题:
双氧水是一种对环境友好的消毒剂、漂白剂,广泛应用于化工、医药、环保等领域.请回答下列问题: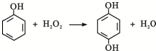 .
. 已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子.
已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子.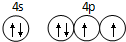 .
.