题目内容
(8分)胆矾晶体是硫酸铜的结晶水合物,其化学式为CuSO4?5H2O。在加热情况下,按温度不同,胆矾晶体会历经一系列的变化,得到不同组成的固体。(第(1)(2)问用小数表示)
(1)称取0.10g含有杂质的胆矾试样于锥形瓶中,加入0.10 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.10 mol/L硫酸滴定到终点,消耗硫酸10.08 mL,则试样中胆矾的质量分数为________(已知:CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4;试样中杂质不与酸碱反应)
(2)将1.250 g 纯净的胆矾晶体置于坩埚中加热一段时间,测得剩余固体质量为0.960 g。剩余固体中结晶水的质量分数为__________(保留三位小数)。
(3)将无水硫酸铜加热至650℃以上,可得到黑色的氧化铜与三氧化硫、二氧化硫和氧气的混合气体。现将9.600 g无水硫酸铜充分加热分解为氧化铜,将生成的气体通过足量的吸收剂(碱石灰),吸收剂增重4.416 g。则最终吸收剂中硫酸盐与亚硫酸盐的物质的量之比为
(4)取x g铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8 960 mL的NO2气体和672 mL N2O4的气体(都已折算到标准状态),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为17.02 g。则x等于
(1)0.98(2分);(2)0.167 (2分)(3)3:2(2分);(4)9.2 (2分).
【解析】
试题分析:n(NaOH)= 0.10 mol/L×0.028L=0.0028mol,n(H2SO4)= 0.10 mol/×0.01008 L=0.001008mol,所以与CuSO4反应的NaOH的物质的量是:0.0028mol-0.001008mol×2=0.000784mol,因此CuSO4的质量是:(0.000784mol÷2)×250g/mol=0.098g, 则试样中胆矾的质量分数为0.098g÷0.10g=0.98;(2)m(CuSO4)= (1.250 g÷250g/mol)×160g/mol=0.8g,所以在剩余固体质量0.960 g中含有的结晶水质量是0.960 g-0.8g=0.160g,因此剩余固体中结晶水的质量分数为0.160g÷0.960 g=0.167;(3)n(CuSO4)= 9.600 g÷160g/mol=0.06mol,将生成的气体通过足量的吸收剂(碱石灰),若转化为硫酸盐1mol,则增重80g,若转化为亚硫酸盐1mol,则增重64g,现在吸收剂增重4.416 g。假设产生的硫酸盐、亚硫酸盐的物质的量分别是xmol、ymol,则根据S原子守恒可得x+y=0.06,80x+64y=4.416。 解得x=0.036mol;y=0.024mol,所以最终吸收剂中硫酸盐与亚硫酸盐的物质的量之比为0.036mol:0.024mol=3:2。(4)在反应过程中Mg、Cu失去的电子与硝酸变为气体得到的电子相等,还等于金属形成沉淀时结合的OH-的物质的量。沉淀的质量就是金属质量与结合的OH-的质量的和。n(e-)=n(OH-) =8.96L÷22.4L/mol + (0.672L÷22.4L)×2=0.46mol,m(OH-)=0.46mol×17g/mol=7.82g,所以铜镁合金质量是17.02 g-7.82g=9.2g。
考点:考查守恒的方法在化学计算中的应用的知识。

 名校课堂系列答案
名校课堂系列答案 、I- B.Na+、Ca2+、CO
、I- B.Na+、Ca2+、CO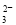 、Al3+
、Al3+