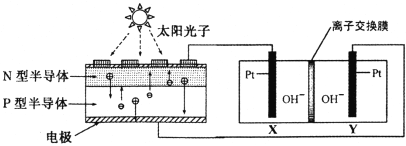
题目内容
【题目】应用电化学原理,回答下列问题:
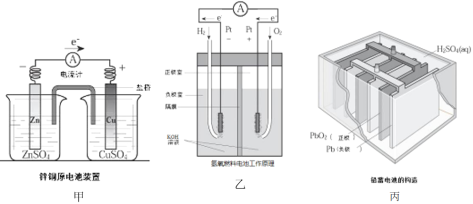
(1)上述三个装置中,负极反应物化学性质上的共同特点是_________。
(2)甲中电流计指针偏移时,盐桥(装有含琼胶的KCl饱和溶液)中离子移动的方向是________。
(3)乙中正极反应式为________;若将H2换成CH4,则负极反应式为_______。
(4)丙中铅蓄电池放电一段时间后,进行充电时,要将外接电源的负极与铅蓄电池______极相连接。
(5)应用原电池反应可以探究氧化还原反应进行的方向和程度。按下图连接装置并加入药品(盐桥中的物质不参与反应),进行实验:

ⅰ.K闭合时,指针偏移。放置一段时间后,指针偏移减小。
ⅱ.随后向U型管左侧逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
① 实验ⅰ中银作______极。
② 综合实验ⅰ、ⅱ的现象,得出Ag+和Fe2+反应的离子方程式是______。
【答案】失电子被氧化,具有还原性 钾离子移向硫酸铜溶液、氯离子移向硫酸锌溶液O2+4e-+2H2O=4OH-CH4-8e-+10OH-=CO32-+7H2O负正Fe2++Ag+![]() Fe3++Ag
Fe3++Ag
【解析】
(1)负极物质中元素化合价升高,发生氧化反应,本身具有还原性,即负极反应物化学性质上的共同特点是失电子被氧化,具有还原性;
(2)阳离子向正极移动,阴离子向负极移动,盐桥中的K+会移向CuSO4溶液,氯离子移向硫酸锌溶液;
(3)正极是氧气得电子发生还原反应生成氢氧根离子,电极反应式为O2+4e-+2H2O=4OH-;若将H2换成CH4,则负极反应式为CH4-8e-+10OH-=CO32-+7H2O;
(4)丙中铅蓄电池放电一段时间后,进行充电时,要将负极中的硫酸铅变成单质铅,发生还原反应,所以应做电解池的阴极,则与电源的负极相连;
(5)①亚铁离子失电子发生氧化反应,所以碳是负极,银是正极;
②综合实验i、ii的现象,得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+![]() Fe3++Ag。
Fe3++Ag。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】工业上以锂辉石为原料生产碳酸锂的部分工业流程如下:
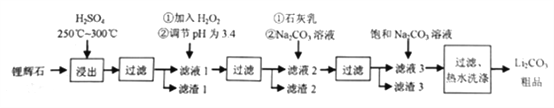
已知:①锂辉石的主要成分为Li2O·Al2O3·4SiO2,其中含少量FeO、MgO等。
②Li2O·Al2O3·4SiO2+H2SO4![]() Li2SO4+Al2O3·4SiO2·H2O
Li2SO4+Al2O3·4SiO2·H2O
③某些物质的溶解度(S)如下表所示。
T℃ | 20 | 40 | 60 | 80 |
S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
④Fe3+完全沉淀时pH为3.4
(1)为提高原料浸出速率,除升高温度外还可采取的措施是__________(任写一条)。
(2)在滤液1中加入H2O2的目的是__________(用离子方程式表示);调节pH最佳试剂是__________(填序号 )。
A.CuO B.CuCO3 C.MgO D.NH3·H2O
(3)从滤渣中分离出Al2O3的流程如下图所示,请写出生成沉淀的离子方程式__________。
![]()
(4)向滤液2中加入Na2CO3溶液的作用是__________。
(5)“过滤、热水洗涤”步骤中,“热水洗涤”的原因是__________;证明沉淀已洗净的操作是__________。