题目内容
【题目】将6.4g铜与足量的浓硫酸在加热情况下充分反应,铜没有剩余.试计算:提示:(Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O)
CuSO4+SO2↑+2H2O)
(1)参加反应的硫酸的物质的量.
(2)生成的SO2的体积(标准状况下).
(3)将反应后的溶液用水稀释到100mL,计算硫酸铜溶液的物质的量浓度.
【答案】
(1)
解:n(Cu)= ![]() =0.1mol,
=0.1mol,
Cu+ | 2H2SO4(浓) |
| CuSO4+ | SO2↑+2H2O |
1mol | 2mol | 1mol | 22.4L | |
0.1mol | n(H2SO4) | n(CuSO4) | V |
n(H2SO4)= ![]() =0.2 mol,
=0.2 mol,
答:参加反应的硫酸的物质的量为0.2mol
(2)
解:V= ![]() =2.24L,答:生成的SO2的体积为2.24L
=2.24L,答:生成的SO2的体积为2.24L
(3)
解:n(CuSO4)=0.1mol,则c(CuSO4)= ![]() =1mol/L,答:硫酸铜溶液的物质的量浓度为1 molL﹣1
=1mol/L,答:硫酸铜溶液的物质的量浓度为1 molL﹣1
【解析】n(Cu)= ![]() =0.1mol,结合反应的方程式计算相关物理量:
=0.1mol,结合反应的方程式计算相关物理量:
Cu+ | 2H2SO4(浓) |
| CuSO4+ | SO2↑+2H2O |
1mol | 2mol | 1mol | 22.4L | |
0.1mol | n(H2SO4) | n(CuSO4) | V |
n(H2SO4)= ![]() =0.2 mol,
=0.2 mol,

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某研究性学习小组用浓度为0.20mol·L-1的盐酸标准液滴定含有一定量杂质的烧碱样品(杂质与酸不反应)溶于水形成的溶液。
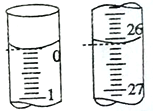
(1)准确量取一定体积的待测液需要使用的仪器是______________。
(2)若滴定开始和结束时,滴定管中的液面如图所示,则消耗盐酸标准液的体积为________mL。
(3)滴定时,若以酚酞为指示剂,滴定达到终点的标志是______________________________。
(4)将准确称取的5.0g烧碱样品配制成250mL待测液,并用盐酸标准液滴定。滴定前读数及滴定后读数如下表所示。
滴定次数 | 待测液体积(mL) | 0.20mol·L-1的盐酸体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 10.00 | 0.70 | 20. 60 |
第一次 | 10.00 | 4.00 | 24.10 |
第三次 | 10.00 | 1.10 | 21.10 |
由实验数据可知,烧碱的纯度为__________。
(5)下列操作会导致测得的待测液的浓度偏大的是________(填字母)。
a.部分标准液滴出锥形瓶外 b.用待测溶液润洗锥形瓶
C.锥形瓶洗净后还留有蒸馏水 d.放出碱液的滴定管开始有气泡,放出液体后气泡消失