题目内容
10.NaAlO2溶液与过量的盐酸反应的化学反应方程式及离子反应方程式:NaAlO2+4HCl=NaCl+AlCl3+2H2O,AlO2-+4H+=Al3++2H2O.分析 偏铝酸钠溶液中通入过量盐酸反应生成氯化铝、氯化钠和水,结合溶于水的强电解质写成离子,来书写离子方程式.
解答 解:偏铝酸钠溶液中通入过量盐酸反应生成氯化铝、氯化钠和水,反应的化学方程式为:NaAlO2+4HCl=NaCl+AlCl3+2H2O,结合溶于水的强电解质写成离子,反应的离子方程式为:AlO2-+4H+=Al3++2H2O,
故答案为:NaAlO2+4HCl=NaCl+AlCl3+2H2O,AlO2-+4H+=Al3++2H2O.
点评 本题考查了物质性质的分析应用,主要是偏铝酸钠溶液加入盐酸,开始生成氢氧化铝沉淀,氢氧化铝是两性氢氧化物,溶于强酸,掌握基础是关键,题目较简单.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
20.下列溶液中微粒的物质的量浓度关系一定正确的是( )
| A. | 0.1mol/LNH4Cl溶液与0.05mol/LNaOH溶液等体积混合后所得的碱性溶液中:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) | |
| B. | pH=2的HA溶液与pH=12的MOH溶液等体积混合:c(M+)=c(A-)>c(OH-)=c(H+) | |
| C. | 等物质的量NaClO、NaHCO3混合溶液:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) | |
| D. | 某二元弱酸的酸式盐NaHA溶液:c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-) |
1.将5.6g Cu、Mg合金投入到一定量的硝酸中,金属与硝酸恰好完全反应,共收集到标准状况下混合气体VL(HNO3被还原为NO和NO2);若向反应后的溶液中加入足量氢氧化钠溶液,待金属元素全部沉淀后,再将沉淀过滤、洗净、干燥后称量质量为10.7g,则收集到的气体体积V值可为( )
| A. | 2.24L | B. | 4.48L | C. | 6.72L | D. | 7.84 |
5.表中所列欲进行分离的混合物,在甲组中选出所用的试剂、乙组中选出所用的主要方法,将其序号填入表中相应栏中.(若无需试剂或方法的请用“/”表示)
甲组:①水 ②氢氧化钠溶液 ③四氯化碳 ④食盐
乙组:A.结晶 B.蒸馏 C.萃取 D.分液
甲组:①水 ②氢氧化钠溶液 ③四氯化碳 ④食盐
乙组:A.结晶 B.蒸馏 C.萃取 D.分液
| 编号 | 混合物 | 试剂序号 | 方法序号 |
| (1) | 硝酸钾和氯化钠的固体混合物 | ||
| (2) | 氯化钾和溴的混合液 | ||
| (3) | 汽油和水的混合物 | ||
| (4) | 乙二醇(沸点198℃)和丙三醇(沸点290℃)的混合物 |
15.异丙基环己烷[ -CH(CH3)2]分子的一氯取代物的同分异构体的数目有( )
-CH(CH3)2]分子的一氯取代物的同分异构体的数目有( )
 -CH(CH3)2]分子的一氯取代物的同分异构体的数目有( )
-CH(CH3)2]分子的一氯取代物的同分异构体的数目有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
2.某溶液中有NH4+、Mg2+、Cu2+,Fe3+四种阳离子,加入过量NaOH溶液,微热并搅拌,再加入足量盐酸,溶液中大量减少的阳离子是( )
| A. | NH4+ | B. | Mg2+ | C. | Cu2+ | D. | Fe3+ |
17.在元素周期表的第四周期的主族元素中,金属元素的种数是( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
18.研究人员研制利用软锰矿浆(主要成分是MnO2)吸收流酸厂的尾气SO2,制备流酸锰的生产流程如下:
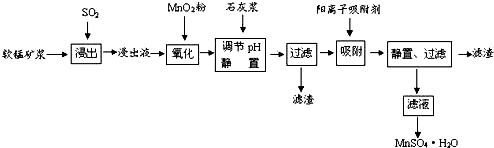
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+,等 其他金属离子,PbO2的氧化性大于MnO2,PbSO4是一种微溶物质.有关金属离子的半径、形成 氢氧化物沉淀时的pH见如表,阳离子吸附剂吸附金属离子的效果见如图.
请回答下列问题:
(1)写出浸出过程中生成反应的化学方程式SO2+MnO2=MnSO4.
(2)氧化过程中主要反应的离子方程式2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是pH计,应调节pH的范围为4.7≤pH<8.3.
(4)阳离子吸附剂可用于除去杂质金属离子•请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有吸附时间、金属离子的半径、金属离子的电荷等;吸附步骤除去的主要离子为:Pb2+、Ca2+.
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10-6.现将c mol•L-1CaCl2溶液与2.00×10-2
mol•L-1Na2SO4溶液等体积混合 (忽略体积的变化),则生成沉淀时,c的最小值是1.82×10-3mol•L-1.

已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+,等 其他金属离子,PbO2的氧化性大于MnO2,PbSO4是一种微溶物质.有关金属离子的半径、形成 氢氧化物沉淀时的pH见如表,阳离子吸附剂吸附金属离子的效果见如图.

| 离子 | 离子半径(pm) | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |
(1)写出浸出过程中生成反应的化学方程式SO2+MnO2=MnSO4.
(2)氧化过程中主要反应的离子方程式2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是pH计,应调节pH的范围为4.7≤pH<8.3.
(4)阳离子吸附剂可用于除去杂质金属离子•请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有吸附时间、金属离子的半径、金属离子的电荷等;吸附步骤除去的主要离子为:Pb2+、Ca2+.
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10-6.现将c mol•L-1CaCl2溶液与2.00×10-2
mol•L-1Na2SO4溶液等体积混合 (忽略体积的变化),则生成沉淀时,c的最小值是1.82×10-3mol•L-1.
