题目内容
16.下列各选项中,表述均正确且具有因果关系的是( )| A | Cl2和SO2混合后可用于漂白纸浆 | Cl2和SO2都有较好的漂白作用 |
| B | 液态钠可用作核反应堆的传热介质 | 金属钠具有强还原性 |
| C | NH3易液化 | NH3分子与水分子间形成氢键 |
| D | 对羟基苯甲醛沸点高于邻羟基苯甲醛 | 对羟基苯甲醛易形成分子间氢键,邻羟基苯甲醛形成分子内氢键 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Cl2和SO2混合生成盐酸和硫酸,不具有漂白性;
B.钠具有良好的导热性,而还原性属于化学性质;
C.氨气分子之间可形成氢键,沸点较高;
D.对羟基苯甲醛易形成分子间氢键,沸点较高.
解答 解:A.Cl2和SO2混合生成盐酸和硫酸,不具有漂白性,故A错误;
B.钠具有良好的导热性,属于物理性质,而还原性属于化学性质,二者没有因果关系,故B错误;
C.氨气分子之间可形成氢键,沸点较高,因与水分子之间形成氢键而易溶于水,二者没有因果关系,故C错误;
D.对羟基苯甲醛易形成分子间氢键,分子间作用力较强,沸点较高,故D正确.
故选D.
点评 本题综合考查元素化合物知识以及氢键等问题,为高考常见题型,侧重双基的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
6.下表是A、B、C、D、E五种有机物的有关信息:
回答下列问题:
(1)A~E中,属于烃的是AB(填字母).A中含官能团名称是碳碳双键.
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br.
(3)C催化氧化生成D的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(4)有机物B具有的性质是②③(填序号).
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色.
| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为  ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成;②球棍模型为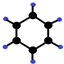 |
| C | ①由C、H、O三种元素组成;②能与Na反应; ③与E反应生成相对分子质量为88的酯 |
| D | ①相对分子质量比C少2;②能由C催化氧化得到 |
| E | ①由C、H、O三种元素组成;②其水溶液能使紫色石蕊试液变红 |
(1)A~E中,属于烃的是AB(填字母).A中含官能团名称是碳碳双键.
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br.
(3)C催化氧化生成D的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(4)有机物B具有的性质是②③(填序号).
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色.
7.下列说法正确的是( )
| A. | 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度、NaOH起始温度和反应后终止温度 | |
| B. | 在101kPa时,1molH2完全燃烧生成水蒸汽,放出285.8kJ热量,H2的燃烧热为△H=-285.8kJ•mol-1 | |
| C. | 在101kPa时,1molC与适量O2反应生成1 mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5kJ•mol-1 | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量等于57.3kJ |
1.在恒温条件下,在醋酸钠稀溶液中分别加入少量下列物质中①固体NaOH②固体KOH③固体NaHSO4④固体醋酸钠⑤冰醋酸,使$\frac{c(CH3COO-)}{c(Na+)}$比值一定增大的是( )
| A. | ①② | B. | ②⑤ | C. | ①⑤ | D. | ②④⑤ |
8.把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液以等体积混和,则混合液中微粒浓度关系正确的为( )
| A. | c(CH3COO-)<c(Na+) | B. | c(OH-)>c(H+) | ||
| C. | c(CH3COOH)>c(CH3COO-) | D. | c(CH3COOH)+c (CH3COO-)=0.02mol/L |
 ;
; ;
; .
. ,请回答下列问题.
,请回答下列问题. ,所用的原料可以是AD
,所用的原料可以是AD .
. H、C、N、O、Mg、Al、Si、S、Cu是中学化学中常见的元素,请根据题意回答与这些元素有关的问题:
H、C、N、O、Mg、Al、Si、S、Cu是中学化学中常见的元素,请根据题意回答与这些元素有关的问题: ;
;