题目内容
在3Cu+8HNO3=3 Cu(NO3)2+2NO↑+4H2O反应中,
(1) 元素被氧化, 是氧化剂.
(2) 是氧化产物, 发生氧化反应.
(3)被还原的HNO3与参加反应的HNO3物质的量之比是 .
(4)用双线桥标出该反应电子转移的方向和数目:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.
(1)
(2)
(3)被还原的HNO3与参加反应的HNO3物质的量之比是
(4)用双线桥标出该反应电子转移的方向和数目:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.
考点:氧化还原反应
专题:氧化还原反应专题
分析:该反应中Cu元素化合价由0价变为+2价、部分N元素化合价由+5价变为+2价,其得失电子最小公倍数是6,所以铜是还原剂、部分硝酸是氧化剂,还原剂发生氧化反应、氧化剂发生还原反应,据此分析解答.
解答:
解:该反应中Cu元素化合价由0价变为+2价、部分N元素化合价由+5价变为+2价,其得失电子最小公倍数是6,
(1)该反应中Cu元素失电子被氧化,硝酸是氧化剂,故答案为:铜;硝酸;
(2)该反应中铜是还原剂,则氧化产物是Cu(NO3)2,还原剂发生氧化反应,所以铜发生氧化反应,故答案为:Cu(NO3)2;Cu;
(3)被还原的硝酸是生成NO的硝酸,则被还原的HNO3与参加反应的HNO3物质的量之比为2:8=1:4,故答案为:1:4;
(4)该反应中Cu元素化合价由0价变为+2价、部分N元素化合价由+5价变为+2价,其得失电子最小公倍数是6,
用双线桥标出该反应电子转移的方向和数目为 ,
,
故答案为: .
.
(1)该反应中Cu元素失电子被氧化,硝酸是氧化剂,故答案为:铜;硝酸;
(2)该反应中铜是还原剂,则氧化产物是Cu(NO3)2,还原剂发生氧化反应,所以铜发生氧化反应,故答案为:Cu(NO3)2;Cu;
(3)被还原的硝酸是生成NO的硝酸,则被还原的HNO3与参加反应的HNO3物质的量之比为2:8=1:4,故答案为:1:4;
(4)该反应中Cu元素化合价由0价变为+2价、部分N元素化合价由+5价变为+2价,其得失电子最小公倍数是6,
用双线桥标出该反应电子转移的方向和数目为
 ,
,故答案为:
 .
.
点评:本题考查了氧化还原反应,从元素化合价变化来分析解答,能用双线桥标出电子转移的方向和数目,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列叙述中正确的是( )
| A、加热蒸干灼烧FeCl3溶液,最后所得固体为Fe(OH)3 |
| B、将pH=4的醋酸溶液稀释后,溶液中所有离子浓度都降低 |
| C、pH相同,体积相同的醋酸溶液和稀硫酸分别与足量锌充分反应,产生氢气的量相同 |
| D、若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的碱性:NaA<NaB |
在化学学习中,利用类比推理是一种学习的好方法.以下类比推理正确的是( )
| A、ⅣA族元素的简单氢化物CH4、SiH4、GeH4、SnH4的沸点随相对分子质量增大而升高,可推知VA族元素氢化物的沸点也具有完全同样的变化规律 |
| B、加热Ca(HCO3)2水溶液,低温蒸发至干,最终产物为CaCO3,从而有Mg(HCO3)2水溶液加热蒸发结晶后的最终产物为MgCO3 |
| C、CO2通入CaCl2溶液中无沉淀生成,因此SO2通入BaCl2溶液中也没有沉淀生成 |
| D、AlCl3溶液中加入Na2S的离子方程式为:2Al3++3S2-+6H2O═2Al(OH)3↓+3H2S↑,可知FeCl3溶液中加入Na2S的离子方程式为:2Fe3++3S2-+6H2O═2Fe(OH)3↓+3H2S↑ |

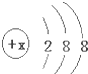 有几种元素的微粒的最外电子层结构如图所示,其中:
有几种元素的微粒的最外电子层结构如图所示,其中: