题目内容
下列关于化学反应和能量变化关系的描述中,说法不正确的是( )
| A、放热反应,不必加热就一定能发生 |
| B、化学反应中一定有能量变化 |
| C、吸热反应不一定需要加热也能发生 |
| D、热化学方程式中,热效应数值与反应物的物质的量多少有关 |
考点:吸热反应和放热反应,化学反应中能量转化的原因
专题:化学反应中的能量变化
分析:A.化学反应发生的条件与反应的热效应无关;
B.化学反应的实质是旧键的断裂和新键的形成,断裂旧键吸收能量,生成新键释放能量,化学反应中一定有能量变化;
C.有的吸热反应不需要任何条件即可发生;
D.参加反应的物质越多,反应热的数值就越大.
B.化学反应的实质是旧键的断裂和新键的形成,断裂旧键吸收能量,生成新键释放能量,化学反应中一定有能量变化;
C.有的吸热反应不需要任何条件即可发生;
D.参加反应的物质越多,反应热的数值就越大.
解答:
解:A.放热的反应在常温下不一定很容易发生,例如铝热反应2 Al+Fe2O3
Al2O3+2Fe是放热反应,但需在高热条件下发生,故A错误;
B.化学反应的实质是旧键的断裂和新键的形成,断裂旧键吸收能量,生成新键释放能量,化学反应中一定有能量变化,故B正确;
C.有的吸热反应不需要任何条件即可发生,如氯化铵和氢氧化钡晶体在常温下就能发生反应,故C正确;
D.不论是吸热还是放热,反应热效应的数值均与参加反应的物质的多少有关.参加反应的物质越多,反应热的数值就越大,反之,越小,故D正确;
故选A.
| ||
B.化学反应的实质是旧键的断裂和新键的形成,断裂旧键吸收能量,生成新键释放能量,化学反应中一定有能量变化,故B正确;
C.有的吸热反应不需要任何条件即可发生,如氯化铵和氢氧化钡晶体在常温下就能发生反应,故C正确;
D.不论是吸热还是放热,反应热效应的数值均与参加反应的物质的多少有关.参加反应的物质越多,反应热的数值就越大,反之,越小,故D正确;
故选A.
点评:本题考查了化学反应的条件与化学反应的热效应间的关系,难度不大,注意化学反应的本质,只要是化学反应一定有能量的变化.

练习册系列答案
相关题目
一定量的盐酸跟过量的铁粉反应时,为了减缓反应的速率,且不影响生成H2的总量,可向反应容器中加入适量的( )
| A、氢氧化钠固体 |
| B、硝酸钠溶液 |
| C、硫酸钾溶液 |
| D、碳酸钠固体 |
下列各组物质中,分子数相同的是( )
| A、2L SO2和2L CO2 |
| B、0.5mol水和标准状况下11.2L CO2 |
| C、标准状况下1mol氧气和22.4L水 |
| D、0.2mol硫化氢气体和2.24 L氯化氢气体 |
A元素的阳离子、B元素的阳离子和C元素的阴离子都具有相同的电子层结构,A的阳离子半径大于B的阳离子半径,则A、B、C三种元素的原子序数由小到大的顺序是( )
| A、A<B<C |
| B、B<C<A |
| C、B<A<C |
| D、C<A<B |
电浮选凝聚法是工业上采用的一种污水处理方法,某研究小组用电浮选凝聚法处理污水,设计装置如图所示,下列说法正确的是( )
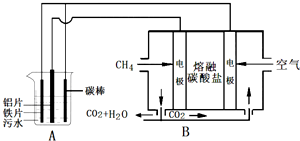

| A、装置A中碳棒为阴极 |
| B、装置B中通入空气的电极反应是O2+2H2O+4e-═4OH- |
| C、污水中加入适量的硫酸钠,既可增强溶液的导电性,又可增强凝聚净化的效果 |
| D、标准状况下,若A装置中产生44.8L气体,则理论上B装置中要消耗CH4 11.2L |
欲检验某无色溶液中是否含有SO42-,为了防止Ag+、CO32-、SO32-等离子的干扰,下列实验方案比较严密的是( )
| A、先加稀盐酸将溶液酸化,再滴加氯化钡溶液,看是否生成白色沉淀 |
| B、先加稀硝酸将溶液酸化,再滴加氯化钡溶液,看是否生成白色沉淀 |
| C、直接向溶液中滴加稀硝酸酸化过的氯化钡溶液,看是否生成白色沉淀 |
| D、直接向溶液中滴加稀盐酸酸化过的氯化钡溶液,看是否生成白色沉淀 |
下列离子方程式中正确的是( )
| A、氨水与亚硫酸溶液混合:NH3?H2O+H+═NH4++H2O | ||||
| B、SO2通入漂白粉溶液中:Ca(ClO)2+SO2+H2O═CaSO3↓+2HClO | ||||
C、铜与浓硫酸共热:Cu+4H++SO42-
| ||||
| D、把H2S通入CuSO4溶液中:H2S+Cu2+═CuS↓+2H+ |
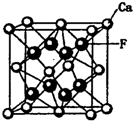 碳、氮、氧、氟都是位于第二周期的重要的非金属元素.请回答下列问题:
碳、氮、氧、氟都是位于第二周期的重要的非金属元素.请回答下列问题: