题目内容
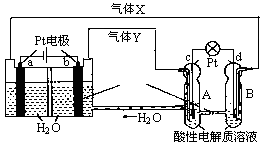
按下图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)
| A.C1上发生还原反应 |
| B.M 装置中SO42-移向Cu电极 |
| C.工作一段时间后装置M 中溶液pH变大,装置N中溶液pH变小 |
| D.Cu电极与C2电极上的电极反应相同 |
CD
解析试题分析:由于金属性:Zn>Cu>C,则图中M装置为原电池,Zn是负极,Cu是正极,N装置为电解池,与正极相连的C1是阳极,阳极上一定发生氧化反应,故A项错误;原电池的内电路中,阴离子一定移向负极,阳离子一定移向正极,因为负极流出带负电的电子,正极流入带负电的电子,由于硫酸根离子是阴离子,所以它移向Zn电极,故B项错误;负极反应式为Zn—2e—=Zn2+,正极反应式为2H++2e—=H2↑,则原电池总反应式为Zn+2H+=Zn2++H2↑,所以M装置中氢离子浓度减小,由于pH=—lgc(H+),则M装置中硫酸溶液的pH增大;由于石墨是惰性电极,则阴极反应式为2H++2e—=H2↑,由于氢氧根离子比硫酸根离子容易失去电子,则阳极反应式为4OH——4e—=2H2O+O2↑,则N装置中电解总反应式为2H2O 2H2↑+O2↑,随着水的消耗,N装置中硫酸浓度增大,酸性增强,则pH减小,故C项正确;Cu是正极,Cu被保护,氢离子移向正极,且氢离子比铜容易得到电子,则正极反应式为2H++2e—=H2↑,C2是阴极,电解池内电路中阳离子移向阴极,氢离子比石墨容易得到电子,则阴极反应式为2H++2e—=H2↑,故D项正确。
2H2↑+O2↑,随着水的消耗,N装置中硫酸浓度增大,酸性增强,则pH减小,故C项正确;Cu是正极,Cu被保护,氢离子移向正极,且氢离子比铜容易得到电子,则正极反应式为2H++2e—=H2↑,C2是阴极,电解池内电路中阳离子移向阴极,氢离子比石墨容易得到电子,则阴极反应式为2H++2e—=H2↑,故D项正确。
考点:考查原电池和电解原理,涉及原电池和电解装置图、电极上反应类型、内电路中阴离子和阳离子定向移动的方向、电极反应式、原电池和电解的总反应式、溶液pH的变化等。

MnO2和Zn是制造普通干电池的重要原料,工业上用软锰矿(主要成分MnO2)和闪锌矿(主要成分ZnS)来制取:
①将软锰矿、闪锌矿与硫酸共热:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O;
②除去反应混合物中的不溶物;
③电解混合物:MnSO4+ZnSO4+2H2O
 MnO2+Zn+2H2SO4
MnO2+Zn+2H2SO4
下列说法错误的是
| A.干电池是一种将化学能转变为电能的装置 |
| B.步骤③电解时MnO2在阳极处生成,电极反应为:Mn2+-2e-+2H2O=MnO2+4H+ |
| C.步骤①每析出12.8g S沉淀,共转移0.8mol电子 |
| D.步骤③的反应也可以设计成原电池 |
Al-AgO 电池性能优越,可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O,则下列说法正确的是
| A.AgO/Ag电极是负极 |
| B.当电极上析出1.08 g Ag时,电路中转移的电子为0.02mol |
| C.Al电极的反应式为:Al—3e-+4OH-= AlO2-+2H2O |
| D.在电解质溶液中OH-由Al电极移向AgO/Ag电极 |
近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应的化学方程式为:KI+3H2O KIO3+3H2↑。下列有关说法不正确的是
KIO3+3H2↑。下列有关说法不正确的是
| A.电解时,石墨作阳极,不锈钢作阴极 |
| B.电解时的阳极电极反应式:I-?6e-+3H2O = IO3-+6H+ |
| C.当电解过程中转移3 mol e-时,理论上可制得KIO3 107 g |
| D.电解一段时间后,电解质溶液的pH变小 |
“天宫一号”飞行器白天靠太阳能帆板产生电流向镍氢电池充电,夜间镍氢电池向飞行器供电。镍氢电池结构示意图如图。若电池总反应为:Ni(OH)2  NiOOH+1/2H2,充电时阴极反应为:H2O+e-=1/2H2+OH-。则下列说法正确的是
NiOOH+1/2H2,充电时阴极反应为:H2O+e-=1/2H2+OH-。则下列说法正确的是
| A.充电时a极为正极 |
| B.放电时NiOOH发生氧化反应 |
| C.充电时,K+向移a极,OH-移向b极 |
| D.放电时正极反应为:NiOOH + H2O +e-= Ni(OH)2 + OH- |
下列有关电池叙述正确的是
| A.化学电池的反应本质是复分解反应 |
| B.铅蓄电池放电时,是电能转变为化学能的过程 |
| C.锌电锰干池碳棒是负极,锌片是正极 |
| D.锌锰干电池工作一段时间后锌外壳逐渐变薄 |
下图所示装置中,观察到电流计指针偏转,M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是( )
| | M | N | P |
| A | 锌 | 铜 | 稀硫酸溶液 |
| B | 铜 | 铁 | 稀盐酸溶液 |
| C | 银 | 锌 | 硝酸银溶液 |
| D | 锌 | 铁 | 硝酸铁溶液 |