题目内容
下图所示装置中,观察到电流计指针偏转,M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是( )
| | M | N | P |
| A | 锌 | 铜 | 稀硫酸溶液 |
| B | 铜 | 铁 | 稀盐酸溶液 |
| C | 银 | 锌 | 硝酸银溶液 |
| D | 锌 | 铁 | 硝酸铁溶液 |
C
解析试题分析:该装置没有外接电源,所以是原电池。原电池中,负极材料比正极材料活泼,且负极材料是随着反应的进行质量减少,正极质量增加或放出气泡。根据题意知,N极是负极,M是正极,且N极材料比M极活泼。
选项A中M极材料比N极活泼,故A错误;选项B中M极上质量不增加,溶液中的氢离子在正极放电,故B错误;选项C中N极材料比M极活泼,且M极上有银析出,所以质量增加,符合题意,故C正确;选项D中M极材料比N极活泼,故D错误,答案选C。
考点:考查原电池原理的应用和判断
点评:该题是高考中的常见题型,属于中等难度的试题。该题的关键是明确原电池的工作原理,然后结合题意和装置图灵活运用即可。能根据电极材料的变化判断正负极是解本题的关键。

按下图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)
| A.C1上发生还原反应 |
| B.M 装置中SO42-移向Cu电极 |
| C.工作一段时间后装置M 中溶液pH变大,装置N中溶液pH变小 |
| D.Cu电极与C2电极上的电极反应相同 |
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入 0.1molCu(OH)2后恰好恢复到电解前的浓度和PH。则电解过程中转移的电子数为( )
| A.0.1mol | B.0.2mol | C.0.3mol | D.0.4mol |
中国在2009年推出了国产燃料电池概念汽车,该车装有“绿色心脏”——质子交换膜燃料电池.如图是某科技杂志登载的该电池原理示意图.下列叙述正确的是( )
| A.工作时“X极”周围溶液的酸性增强 |
| B.氢气在电极上发生还原反应 |
| C.图中标出的“Y极”实际是原电池的负极 |
| D.工作过程中,质子(H+)从“Y极”一边透过质子交换膜移动到“X极”一边与OH-反应生成水 |
下图为铜锌原电池示意图,下列说法正确的是
| A.电子由铜片通过导线流向锌片 |
| B.烧杯中溶液逐渐呈蓝色 |
| C.锌片逐渐溶解 |
| D.该装置能将电能转变为化学能 |
有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
| 实验装置 |  |  |  |  |
| 部分实验现象 | a极质量减小 b极质量增加 | b极有气体产生 c极无变化 | d极溶解 c极有气体产生 | 电流计指示在导线中 电流从a极流向d极 |
A.a>b>c>d B.b>c>d>a C.d>a>b>c D.a>b>d>c
如图装置,U型管中盛有Fe(OH)3胶体,以两个碳棒为电极进行电解,一段时间后,下列叙述正确的是
| A.x是阳极,y是阴极 |
| B.x极附近颜色变深,y极近颜色变浅 |
| C.x是阴极,y极附近颜色加深 |
| D.y是阴极,x极附近颜色加深 |
(15分)制烧碱所用盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.滤液用盐酸调节pH,获得一次精制盐水。
(1)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
②过程Ⅰ选用BaCl2而不选用CaCl2,运用表中数据解释原因____________________。
③除去Mg2+的离子方程式是_______________________________。
④检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测_______(填离子符号)。
(2)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如下:
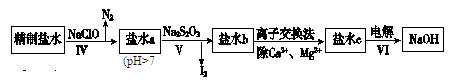
①过程Ⅳ除去的离子是________________。
②盐水b中含有SO42-。Na2S2O3将IO3-还原为I2的离子方程式是________________。
③过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释:___________。

