题目内容
20.把4.35g二氧化锰跟100g36.5%酸混合,加热后能生成氯气多少升(标准状况下)?分析 发生反应:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+H2O,根据n=$\frac{m}{M}$计算二氧化锰的物质的量,根据方程式计算氯气的物质的量,再根据V=nVm计算氯气体积.
解答 解:4.35g二氧化锰的物质的量=$\frac{4.35g}{87g/mol}$=0.05mol,
HCl的质量为100g×36.5%=36.5g,所以物质的量为:$\frac{36.5g}{36.5g/mol}$=1mol,
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
1 4
0.05mol 0.2mol
所以盐酸过量,二氧化锰不足,n( Cl2)=n(MnO2)=0.05mol,
故标况下,生成氯气得到体积=0.05mol×22.4L/mol=1.12L,
答:标况下生成氯气体积为1.12L.
点评 本题考查化学方程式有关计算,比较基础,注意浓盐酸与二氧化锰,而稀盐酸不反应,有利于基础知识的巩固.

练习册系列答案
相关题目
10.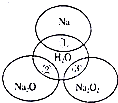 如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )
如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )
 如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )
如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )| A. | 反应③最多能产生0.05molO2 | |
| B. | 反应①的离子方程式为Na+2H2O=Na++2OH-+H2↑ | |
| C. | ①、②、③都属于氧化还原反应 | |
| D. | ①、②、③充分反应后所得溶液中溶质的质量分数:①>②>③ |
11.“温室效应”是全球关注的环境问题之一.CO2是目前大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.将CO2转化成有机物可有效实现碳循环.CO2转化成有机物的例子很多,如:
①6CO2+6H2O$\stackrel{光合作用}{→}$C6H12O6+6O2
②CO2+3H2$→_{△}^{催化剂}$CH3OH+H2O
③CO2+CH4$→_{△}^{催化剂}$CH3COOH
④2CO2+6H2$→_{△}^{催化剂}$CH2═CH2+4H2O
关于以上反应的说法,不正确的是( )
①6CO2+6H2O$\stackrel{光合作用}{→}$C6H12O6+6O2
②CO2+3H2$→_{△}^{催化剂}$CH3OH+H2O
③CO2+CH4$→_{△}^{催化剂}$CH3COOH
④2CO2+6H2$→_{△}^{催化剂}$CH2═CH2+4H2O
关于以上反应的说法,不正确的是( )
| A. | 反应①是最节能的,同时原子利用率最高 | |
| B. | 反应①是最节能的,反应③的原子利用率最高 | |
| C. | 在反应②中,CO2作为氧化剂 | |
| D. | 反应④得到的产物可以作为生产塑料的原料 |
8.化学实验中安全意识是重要的科学素养,下列实验操作或事故处理操作中正确的是( )
| A. | 酒精灯不慎碰倒起火时可用水扑灭 | |
| B. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| C. | 配制硫酸溶液时,可先在量筒中加入一定量的水,再在搅拌条件下加入浓硫酸 | |
| D. | 做“氢气还原氧化铜”的实验时,先加热再通氢气 |
15.将钠加入到下列溶液中,既产生气体又产生沉淀的是( )
| A. | KCl | B. | CuSO4 | C. | NH4Cl | D. | KNO3 |
1.关于工业制硫酸的说法不正确的是( )
| A. | 燃烧硫生成SO3 | B. | SO3与水反应生成H2SO4 | ||
| C. | SO2氧化成SO3需要使用催化剂 | D. | 主要设备是沸腾炉、接触室、吸收塔 |
8.有机物的命名是有规则的,下列有机物命名正确的是( )
| A. | CH2=CH-CH=CH2 1,3-二丁烯 | B. | 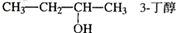 | ||
| C. | 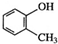 甲基苯酚 甲基苯酚 | D. | 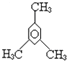 1,3,5-三甲基苯 1,3,5-三甲基苯 |
5.在无色溶液里能大量共存,但加入盐酸后不能大量共存的离子组是( )
| A. | Fe3+、K+、Ag+、NO3-、 | B. | Na+、K+、CO32-、C1- | ||
| C. | NH4+、Al3+、Cl-、NO3- | D. | Mg2+、Na+、CO32-、SO42- |
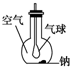 如图所示装置,在平底烧瓶的底部有一块钠,平底烧瓶内是干燥的空气.过一段时间后可观察到钠表面变暗,气球膨胀,发生反应的化学方程式为4Na+O2═2Na2O.
如图所示装置,在平底烧瓶的底部有一块钠,平底烧瓶内是干燥的空气.过一段时间后可观察到钠表面变暗,气球膨胀,发生反应的化学方程式为4Na+O2═2Na2O.