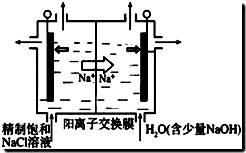
题目内容
20.下列叙述正确的是( )| A. | 高温下二氧化硅与碳酸钠反应放出二氧化碳,说明硅酸(H2SiO3)的酸性比碳酸强 | |
| B. | 陶瓷、玻璃、水泥容器都能贮存氢氟酸 | |
| C. | 石灰抹墙、水泥砌墙的硬化过程原理不相同 | |
| D. | 硫酸钠溶液、烧碱溶液、硝酸溶液、浓硫酸四种溶液均能用带玻璃塞的试剂瓶保存 |
分析 A.根据反应条件分析,该反应条件不是常温下溶液中,所以不能据此判断酸性强弱;
B.根据陶瓷、玻璃、水泥容器的成分分析,二氧化硅能和HF反应;
C.石灰抹墙硬化是利用氢氧化钙和二氧化碳的反应,水泥砌墙是利用水泥的凝固性;
D.玻璃的成分中含有二氧化硅,二氧化硅是酸性氧化物,能和强碱反应,能和氢氟酸反应,带玻璃塞的试剂瓶不能存放呈强碱性的物质;
解答 解:A.高温条件下,虽然二氧化硅和碳酸钠反应生成二氧化碳,但该反应条件是高温而不是常温,所以不能据此判断酸性强弱,应根据溶液中进行的反应来判断,故A错误;
B.陶瓷、玻璃、水泥的主要成分都是硅酸盐,玻璃中含有二氧化硅,二氧化硅和HF反应生成SiF4,所以不能用玻璃容器盛放HF,故B错误;
C.石灰抹墙硬化发生的反应为Ca(OH)2+CO2=CaCO3↓+H2O,水泥砌墙是利用水泥的凝固性,所以原理不同,故C正确;
D.硫酸钠溶液,不和二氧化硅反应,所以可以带玻璃塞的试剂瓶盛放,硝酸呈酸性,不和二氧化硅反应,所以可以带玻璃塞的试剂瓶盛放,浓硫酸呈酸性,不和二氧化硅反应,所以可以带玻璃塞的试剂瓶盛放,氢氧化钠呈强碱性,能和二氧化硅反应生成硅酸钠,硅酸钠具有黏性,能把玻璃塞黏住,所以不可以带玻璃塞的试剂瓶盛放,故D错误;
故选C.
点评 本题考查了无机非金属材料硅及其化合物的性质,陶瓷、玻璃、水泥容器和强酸不反应,但能和氢氟酸反应,所以不能用陶瓷、玻璃、水泥容器贮存氢氟酸,注意D化学试剂的存放,题目难度不大.

练习册系列答案
相关题目
10.下列化工生产过程中所发生的主要化学反应不属于氧化还原反应的是( )
| A. | 用氯气和消石灰制漂白粉 | B. | 铝热法冶炼金属钒 | ||
| C. | 用石灰石、纯碱、二氧化硅制玻璃 | D. | 电解饱和食盐水制烧碱 |
11.人类利用无机物合成的第一种有机物是( )
| A. | 电石气 | B. | 甲烷 | C. | 尿素 | D. | 醋酸 |
8.313K时,水的Kw=3.0×10-14,则在313K时,c(H+)=10-7 mol/L的溶液( )
| A. | 呈酸性 | B. | 呈中性 | C. | 呈碱性 | D. | 无法判断 |
5.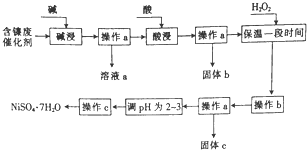 某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O,已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O,已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
部分阳离子以氢氧化物形式沉淀时的pH如下:
(1)操作a的名称是过滤.
(2)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O.
(3)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1.
(4)溶液a中加入盐酸可制得AlCl3溶液,AlCl3溶液可用于制备聚合氯化铝.聚合氯化铝是一种新型净水剂,其中铝主要以[AlO4Al12(OH)2(H2O)12]2+(用Alb表示)的形式存在.
①写出用溶液a与盐酸反应制备AlCl3的离子方程式:AlO2-+4H+=Al3++2H2O.
②一定条件下,向1.0mol•L-1的AlCl3溶液中加入0.6mol•L-1的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液.写出生成[AlO4Al12(OH)24(H2O)22]2+的离子方程式:13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+.
 某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O,已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O,已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).部分阳离子以氢氧化物形式沉淀时的pH如下:
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| FE(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
(2)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O.
(3)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1.
(4)溶液a中加入盐酸可制得AlCl3溶液,AlCl3溶液可用于制备聚合氯化铝.聚合氯化铝是一种新型净水剂,其中铝主要以[AlO4Al12(OH)2(H2O)12]2+(用Alb表示)的形式存在.
①写出用溶液a与盐酸反应制备AlCl3的离子方程式:AlO2-+4H+=Al3++2H2O.
②一定条件下,向1.0mol•L-1的AlCl3溶液中加入0.6mol•L-1的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液.写出生成[AlO4Al12(OH)24(H2O)22]2+的离子方程式:13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+.
12.关于实现下列物品用途的主要物质的说法,不正确的是( )
| A. | 硫酸是铅蓄电池的电解质溶液,铅蓄电池可实现化学能转变成电能 | |
| B. | 硅酸干凝胶是硅酸干燥剂的主要成分,作用是吸收水分 | |
| C. | 肥皂的主要成分是硬脂酸钠,可以用于除去油污 | |
| D. | 二氧化硅是光能转化为电能的转化材料 |
6.金属材料是使用最广泛的一种材料,从古代到现代,金属材料经历了几次较大的变革.请回答下列问题:
(1)下面表格中的数据(铁和铜的某些物理数据)摘自某化学手册.
由表可推知,人类最早使用的金属材料是铜,请写出判断的理由:铜的熔点低于铁的熔点.
(2)考古中出土的青铜器、铁剑等往往锈迹斑斑.请完成下面铜、铁制品在自然条件下发生锈蚀的化学方程式:
①□Cu+□O2+□H2O+□CO2═□Cu2(OH)2CO3
②□Fe+□O2+□H2O═□Fe2O3•nH2O
(3)镁、铝是现代人常用的金属材料,这些活泼金属的冶炼方法是电解法,工业生产中,镁的冶炼采用的反应物是熔融氯化镁(或MgCl2),铝的冶炼采用的反应物是熔融氧化铝(或Al2O3).
(1)下面表格中的数据(铁和铜的某些物理数据)摘自某化学手册.
| 金属 | 颜色 | 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 比热[KJ/kg•℃] |
| Fe | 银白色 | 7.86 | 1 535 | 2 750 | 0.44 |
| Cu | 红色 | 8.92 | 1 083 | 2 567 | 0.38 |
(2)考古中出土的青铜器、铁剑等往往锈迹斑斑.请完成下面铜、铁制品在自然条件下发生锈蚀的化学方程式:
①□Cu+□O2+□H2O+□CO2═□Cu2(OH)2CO3
②□Fe+□O2+□H2O═□Fe2O3•nH2O
(3)镁、铝是现代人常用的金属材料,这些活泼金属的冶炼方法是电解法,工业生产中,镁的冶炼采用的反应物是熔融氯化镁(或MgCl2),铝的冶炼采用的反应物是熔融氧化铝(或Al2O3).
7.运用化学反应原理研究NH3的性质具有重要意义.
(1)科学家一直致力于“人工固氮”的新方法研究.据报道,在光照条件下,N2在催化剂表面与水发生反应生成NH3和另一种单质.在使用催化剂和不使用催化剂时,该反应过程和能量的变化关系如图所示.
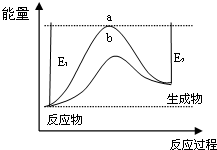
①写出该反应的化学方程式2N2+6H2O$\frac{\underline{\;催化剂\;}}{光照}$4NH3+3O2.
②a和b相比,二者的平衡常数关系是Ka=Kb(填“>”、“=”或“<”).
③升高温度,平衡时NH3的含量增大(填“增大”、“不变”或“减小”).
(2)在 0.5L的密闭容器中,一定量的 N2和H2发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,
400℃时,K=0.5,某一时刻测得N2、H2 和NH3三种物质物质的量分别为2mol、2mol和3mol,则该反应的v正(N2)>v逆(N2)(填“>”“=”或“<”).
(3)将NH3气体通入稀盐酸中,若存在[NH4+]>[Cl-]>[OH-]>[H+]的关系,此时所得溶液的溶质是NH3.H2O、NH4Cl(填化学式).
(4)NH3的催化氧化反应是工业制HNO3的关键步骤,测得某温度下固定容积的容器中的数据为:
①则2~4min内,v(O2)=0.0625mol/(L.min).
②在第8min时改变条件,你认为改变的条件可能是增大NO的浓度.
(1)科学家一直致力于“人工固氮”的新方法研究.据报道,在光照条件下,N2在催化剂表面与水发生反应生成NH3和另一种单质.在使用催化剂和不使用催化剂时,该反应过程和能量的变化关系如图所示.

①写出该反应的化学方程式2N2+6H2O$\frac{\underline{\;催化剂\;}}{光照}$4NH3+3O2.
②a和b相比,二者的平衡常数关系是Ka=Kb(填“>”、“=”或“<”).
③升高温度,平衡时NH3的含量增大(填“增大”、“不变”或“减小”).
(2)在 0.5L的密闭容器中,一定量的 N2和H2发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,
400℃时,K=0.5,某一时刻测得N2、H2 和NH3三种物质物质的量分别为2mol、2mol和3mol,则该反应的v正(N2)>v逆(N2)(填“>”“=”或“<”).
(3)将NH3气体通入稀盐酸中,若存在[NH4+]>[Cl-]>[OH-]>[H+]的关系,此时所得溶液的溶质是NH3.H2O、NH4Cl(填化学式).
(4)NH3的催化氧化反应是工业制HNO3的关键步骤,测得某温度下固定容积的容器中的数据为:
| 浓度/mol•L-1 时间 | c(NH3) | c(O2) | c(NO) |
| 0min | 1.000 | 1.600 | 0.000 |
| 2min | 0.600 | a | 0.400 |
| 4min | 0.500 | 0.975 | 0.500 |
| 6min | 0.500 | 0.975 | 0.500 |
| 8min | 0.700 | 1.225 | 0.750 |
②在第8min时改变条件,你认为改变的条件可能是增大NO的浓度.