题目内容
15.设NA为阿伏伽德罗常数的值.下列叙述正确的是( )| A. | 1mol Fe溶于过量稀硝酸,电子转移数为2NA | |
| B. | 标准状况下,2.24L CCl4含有分子的数目为0.1NA | |
| C. | 46g NO2和N2O4混合气体中含有原子总数为3NA | |
| D. | 7.8g Na2O2中含有阴离子的数目为0.2NA,与足量水反应时电子转移了0.1NA |
分析 A、铁和过量硝酸反应后变为+3价;
B、标况下四氯化碳为液体;
C、NO2和N2O4的最简式均为NO2;
D、求出过氧化钠的物质的量,然后根据过氧化钠由2个钠离子和1个过氧根构成来分析;且过氧化钠和水的反应为歧化反应,1mol过氧化钠转移1mol电子.
解答 解:A、铁和过量硝酸反应后变为+3价,故1mol铁转移3NA个电子,故A错误;
B、标况下四氯化碳为液体,故不能根据气体摩尔体积来计算物质的量,故B错误;
C、NO2和N2O4的最简式均为NO2,故46g混合物中含有的NO2的物质的量为1mol,故含3NA个原子,故C正确;
D、7.8g过氧化钠的物质的量为0.1mol,而过氧化钠由2个钠离子和1个过氧根构成,故0.1mol过氧化钠中含0.1NA个阴离子;且过氧化钠和水的反应为歧化反应,1mol过氧化钠转移1mol电子,故0.1mol过氧化钠转移0.1NA个电子,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
6.下列叙述不正确的是( )
| A. | 1 mol H2约含有6.02×1023个氢分子 | |
| B. | 1 mol H2O的质量为18 g | |
| C. | 1 mol O2的体积为22.4 L | |
| D. | 1L 1 mol/L NaCl溶液中含1 molNa+ |
3.常温下,在符合各自条件的下列溶液中一定能大量共存的离子组是( )
| A. | 与Al反应产生氢气的溶液:K+、Na+、SO42-、HCO3- | |
| B. | 溶液中c(H+)/c(OH-)=1014:Fe2+、Na+、SO42-、NO3- | |
| C. | PH=12的溶液:Na+、K+、AlO2-、Cl- | |
| D. | 溶液中水所电离的H+和OH-满足c(H+)•c(OH-)=10-26:NH4+、Mg2+、SO42-、Cl- |
10.下列有关气体体积的叙述中,正确的是( )
| A. | 同温同压条件下,反应前后气体的体积之比等于气体的物质的量之比 | |
| B. | 不同的气体,若体积相同,则它们所含的分子数必相同 | |
| C. | 气体的摩尔体积是指1mol任何气体所占的体积都是22.4L | |
| D. | 一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定 |
20.最近科学家在洛夫乔伊彗星上侦测到乙醇和乙醇醛(HOCH2CHO ),下列说法不正确的是( )
| A. | 乙醇和乙醇醛都能发生加成反应 | |
| B. | 乙醇和乙醇醛都能与金属钠发生反应 | |
| C. | 乙醇醛的一种同分异构体可以与NaHCO3溶液反应 | |
| D. | 等物质的量的乙醇与乙醇醛分别完全燃烧,消耗O2的物质的量之比为3:2 |
7.已知反应10AgF+5Cl2+5H2O=9AgCl+AgClO3+10HF+O2,则有1molO2生成时反应所转移的电子总数为(NA表示阿伏加德罗常数的值)( )
| A. | 9 NA | B. | 4 NA | C. | 10 NA | D. | 5 NA |
4.基态原子的核外电子排布为[Kr]4d105s1的元素属于的区、周期和族为( )
| A. | p区、第五周期、ⅠB族 | B. | ds区、第五周期、ⅠB族 | ||
| C. | d区、第四周期、ⅠB族 | D. | ds区、第五周期、Ⅷ族 |
5.下列化学用语表达不正确的是( )
| A. | 氨分子的电子式: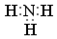 | B. | CO2分子的结构式:O=C=O | ||
| C. | S2-的离子结构示意图: | D. | 苯分子的结构简式: |
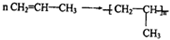
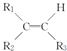 $\stackrel{KMnO_{4}(H+)}{→}$
$\stackrel{KMnO_{4}(H+)}{→}$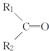 +R3-COOH,
+R3-COOH,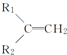 $\stackrel{KMnO_{4}(H+)}{→}$
$\stackrel{KMnO_{4}(H+)}{→}$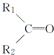 +CO2
+CO2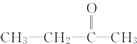 ),则此烯烃的结构简式是CH2=C(CH3)C2H5.
),则此烯烃的结构简式是CH2=C(CH3)C2H5.