题目内容
在常压和120℃时,在密闭容器中充入H2S和O2的混合气体共100mL,用电火花点燃,经充分反应后,恢复到原状况,测定容器内残留气体体积,经测定,残留气体体积V随原混合气体中O2的体积![]() 增加而变化,其关系如下图所示.
增加而变化,其关系如下图所示.

(1)将图中A、B、C各点的数据填入下表.

(2)讨论V和![]() 的关系并用含V和
的关系并用含V和![]() 的函数式表示.
的函数式表示.
解析:
|
①
②当 当 |

20.在常压和120℃时,在密闭容器中充入H2S和O2的混合气体共100 mL,用电火花点燃,经充分反应后,恢复到原状况,测定容器内残留气体的体积。经测定,残留气体的体积V1随原混合气体中O2的体积V2(O2)增加而变化,其关系如右图所示。
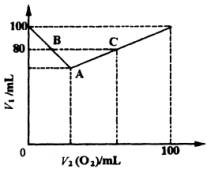
(1)把A、B、C各点的有关数据填入下表:
|
|
A |
B |
C |
|
反应前混合气体各成分体积 |
|
|
|
|
反应后残留气体各成分体积 |
|
|
|
(2)讨论V1和V2(O2)的关系,并用含V1和V2(O2)的函数式表示之。
(3)若残留气体体积V1=90mL,原混合气体的成分是________或________。

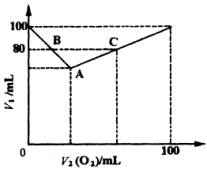
(1)把A、B、C各点的有关数据填入下表:
|
|
A |
B |
C |
|
反应前混合气体各成分体积 |
|
|
|
|
反应后残留气体各成分体积 |
|
|
|
(2)讨论V1和V2(O2)的关系,并用含V1和V2(O2)的函数式表示之。
(3)若残留气体体积V1=90mL,原混合气体的成分是________或________。
(14分)水煤气是一种高效气体燃料,其主要成分是CO和H2,可用水蒸气通过炽热的炭制得:C (s) + H2O(g) CO (g) +H2 (g) △H=+131kJ?mol-1
CO (g) +H2 (g) △H=+131kJ?mol-1
⑴T温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
| 容器 编号 | c(H2O) /mol·L-1 | c(CO) /mol·L-1 | c(H2) /mol·L-1 | v正、v逆比较 |
| I | 0.06 | 0.60 | 0.10 | v正=v逆 |
| II | 0.06 | 0.50 | 0.40 | ① |
| III | 0.12 | 0.40 | 0.80 | v正<v逆 |
| IV | 0.12 | 0.30 | ② | v正=v逆 |
⑵另有一个容积可变的密闭容器。恒温恒压下,向其中加入1.0mol炭和1.0 mol水蒸气 (H2O),发生上述反应,达到平衡时,容器的体积变为原来的1.25 倍。平衡时水蒸气的转化率为 ;向该容器中补充a mol 炭,水蒸气的转化率将 (填 “增大”、“减小”、“不变”)。
⑶在一定条件下用水煤气能合成甲醇:CO(g)+2H2(g)
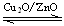 CH3OH(g) △H>0给合成甲醇反应体系中通入少量CO则平衡向 移动,减小压强则平衡向 移动,降低温度则平衡向 移动(填左,右,不)
CH3OH(g) △H>0给合成甲醇反应体系中通入少量CO则平衡向 移动,减小压强则平衡向 移动,降低温度则平衡向 移动(填左,右,不)⑷熔融盐燃料电池具有高的发电效率,该电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,其中一极通入CO,另一极通入空气和CO2的混合气体。根据上述信息,该燃料电池:负极反应式为 ;正极反应式为 。
(5)已知在常温常压下:
①2CH3OH (l)+3O2 (g) == 2CO2 (g)+4H2O (g) ΔH1=-1 275.6 kJ·mol-1
②2CO (g)+O2 (g) == 2CO2 (g) ΔH2=-566.0 kJ·mol-1
③H2O (g) = H2O (l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________________
