题目内容
甲醇(CH3OH)被称为21世纪的新型燃料,以煤为原料制备甲醇的流程如下:
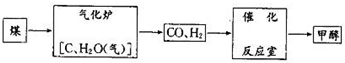
(1)气化炉中主要反应的化学方程式为 .
(2)已知CO、H2、甲醇(I)的燃烧热分别为:-285.8kJ/mol、-283kJ/mol、-726.5kJ/mol,则CO和H2合成甲醇的热化学方程式为 .
(3)一定条件下,在催化反应室中发生反应:CO(g)十2H(g)?CH3OH(g)△H<0;CO的平衡转化率与温度、压强的关系如图所示,回答下列问题:
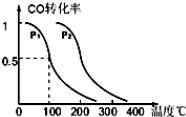
①工业上,上述匣应温度不宜过高,原因是 ;
②若反应是1mol CO与2mol H2在2L容积中进行,则100°、P1下,该反应的平衡常数为 ;维持温度、容积不变,催化反应室再增加1mol CO与2mol H2,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”).

(1)气化炉中主要反应的化学方程式为
(2)已知CO、H2、甲醇(I)的燃烧热分别为:-285.8kJ/mol、-283kJ/mol、-726.5kJ/mol,则CO和H2合成甲醇的热化学方程式为
(3)一定条件下,在催化反应室中发生反应:CO(g)十2H(g)?CH3OH(g)△H<0;CO的平衡转化率与温度、压强的关系如图所示,回答下列问题:

①工业上,上述匣应温度不宜过高,原因是
②若反应是1mol CO与2mol H2在2L容积中进行,则100°、P1下,该反应的平衡常数为
考点:煤的干馏和综合利用,热化学方程式,化学平衡的影响因素
专题:化学平衡专题
分析:(1)根据碳和水蒸气在高温下反应生成一氧化碳和氢气;
(2)先根据燃烧热分别写出CO、H2、CH3OH热化学方程式后,根据盖斯定律就可得出CO和H2合成甲醇的热化学方程式;
(3)①温度对化学平衡的影响来分析;
②由图可知,100℃、P1下达到平衡时CO的转化率为0.5,则转化的n(CO)=1mol×0.5=0.5mol,平衡时c(CO)=
=0.25mol/L,c(H2)=
=0.5mol/L,c(CH3OH)=
=0.25mol/L,然后带入化学平衡常数K=
;维持温度、容积不变,催化反应室再增加1mol CO与2mol H2,相当于增压,根据压强对化学平衡的影响来判断.
(2)先根据燃烧热分别写出CO、H2、CH3OH热化学方程式后,根据盖斯定律就可得出CO和H2合成甲醇的热化学方程式;
(3)①温度对化学平衡的影响来分析;
②由图可知,100℃、P1下达到平衡时CO的转化率为0.5,则转化的n(CO)=1mol×0.5=0.5mol,平衡时c(CO)=
| 1mol×(1-0.5) |
| 2L |
| 2mol-1mol |
| 2L |
| 0.5mol |
| 2L |
| c(CH3OH) |
| c(CO).c2(H2) |
解答:
解:(1)碳和水蒸气在高温下反应生成一氧化碳和氢气,方程式为:C+H2O(气)
CO+H2;
故答案为:C+H2O(气)
CO+H2;
(2)CO燃烧的热化学方程式:CO(g)+
O2(g)═CO2(g)△H=-285.8kJ?mol-1 ①
H2燃烧的热化学方程式:2H2(g)+O2(g)═2H2O(l)△H=-283×2 kJ?mol-1 ②
CH3OH燃烧的热化学方程式:CH3OH(l)+
O2(g)═CO2(g)+2H2O(l)△H=-726.5kJ?mol-1 ③
根据盖斯定律将①+②+(-③)可得:CO(g)+2H2(g)═CH3OH(l)△H=-125.3KJ?mol-1,
故答案为:CO(g)+2H2(g)═CH3OH(l)△H=-125.3KJ?mol-1;
(3)①该反应为放热反应,温度过高,平衡逆向移动,CH3OH产率降低;
故答案为:该反应为放热反应,温度过高,平衡逆向移动,CH3OH产率降低;
②由图可知,100℃、P1达到平衡时CO的转化率为0.5,则转化的n(CO)=1mol×0.5=0.5mol,平衡时c(CO)=
=0.25mol/L,c(H2)=
=0.5mol/L,c(CH3OH)=
=0.25mol/L,化学平衡常数K=
=
=4;维持温度、容积不变,催化反应室再增加1mol CO与2mol H2,相当于增压,压强增大,平衡向正反应方向移动,CO的转化率增大;
故答案为:4;增大;
| ||
故答案为:C+H2O(气)
| ||
(2)CO燃烧的热化学方程式:CO(g)+
| 1 |
| 2 |
H2燃烧的热化学方程式:2H2(g)+O2(g)═2H2O(l)△H=-283×2 kJ?mol-1 ②
CH3OH燃烧的热化学方程式:CH3OH(l)+
| 3 |
| 2 |
根据盖斯定律将①+②+(-③)可得:CO(g)+2H2(g)═CH3OH(l)△H=-125.3KJ?mol-1,
故答案为:CO(g)+2H2(g)═CH3OH(l)△H=-125.3KJ?mol-1;
(3)①该反应为放热反应,温度过高,平衡逆向移动,CH3OH产率降低;
故答案为:该反应为放热反应,温度过高,平衡逆向移动,CH3OH产率降低;
②由图可知,100℃、P1达到平衡时CO的转化率为0.5,则转化的n(CO)=1mol×0.5=0.5mol,平衡时c(CO)=
| 1mol×(1-0.5) |
| 2L |
| 2mol-1mol |
| 2L |
| 0.5mol |
| 2L |
| c(CH3OH) |
| c(CO).c2(H2) |
| 0.25 |
| 0.25×0.52 |
故答案为:4;增大;
点评:本题主要考查了热化学方程式式、盖斯定律以及外界条件对化学平衡的影响,难度不大,注意知识的运用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
N-H键键能为391.5kJ/mol,其含义是( )
| A、由N和H形成1 mol NH3所放出的能量 |
| B、把1 mol NH3中的共价键全部拆开所吸收的能量 |
| C、拆开NA个N-H键所吸收的能量 |
| D、形成1个 N-H键所放出的能量 |
 有机化学中有如下的转化关系:C2H4→CH3CH2OH→CH3CHO→CH3COOH
有机化学中有如下的转化关系:C2H4→CH3CH2OH→CH3CHO→CH3COOH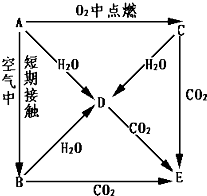 A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,已知A金属为单质.
A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,已知A金属为单质.