题目内容
有一块镁铝合金,其中镁与铝的质量比是8:9.加入足量稀H2SO4使其完全溶解后,再加入NaOH溶液,生成沉淀的质量随NaOH溶液体积变化的曲线如图,其中正确的是( )
A、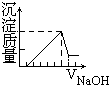 |
B、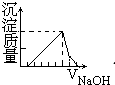 |
C、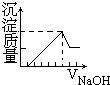 |
D、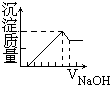 |
考点:铝的化学性质,镁的化学性质
专题:元素及其化合物
分析:镁与铝的质量比是8:9,则物质的量之比为:
=1:1,由图象可知,金属与酸反应时酸过量,由Al(OH)3+NaOH═NaAlO2+2H2O来计算消耗碱的量,由发生Al3++3OH-═Al(OH)3↓、Mg2++2OH-═Mg(OH)2↓来计算消耗碱的量,然后分析得出结论.
| ||
|
解答:
解:镁与铝的质量比是8:9,则物质的量之比为:
=1:1,由图象可知,金属与酸反应时酸过量,设铝的量为1单元,利用铝守恒,铝的量与氢氧化铝的物质的量相等,Al(OH)3+NaOH═NaAlO2+2H2O,得到消耗碱的量也为1个单元,由发生Al3++3OH-═Al(OH)3↓消耗碱为3单元,而Mg2++2OH-═Mg(OH)2↓反应消耗碱为2单元,所以从沉淀生成到最大量到沉淀溶解碱的体积之比为(3+2):1=5:1,而且等物质量的氢氧化铝的质量大于氢氧化镁,故选A.
| ||
|
点评:本题考查镁、铝及其化合物的性质,明确发生的化学反应及反应与图象的关系是解答本题的关键,难度较大.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
将28克铁粉溶于500mL的某稀硝酸溶液中,二者刚好完全反应,已知还原产物只有NO,且反应后的溶液比反应前增加了16克,则原硝酸浓度是( )mol/L.
| A、6.4 | B、4.8 |
| C、3.2 | D、2.4 |
下列关于氢氧化铁胶体的叙述,正确的是( )
| A、往氢氧化铁胶体中逐滴加入稀盐酸先出现沉淀后沉淀溶解 |
| B、在含2 mol的氢氧化铁的胶体中含有氢氧化铁胶粒数为2NA |
| C、滤纸可将氢氧化铁胶体中的分散质与分散剂分离 |
| D、氢氧化铁胶体带正电荷 |
分类法是一种行之有效、简单易行的科学方法,人们在认识事物时可以采取多种分类方法,下列关于“NaHCO3”的分类错误的是( )
| A、酸式盐 | B、可溶盐 | C、钠盐 | D、酸 |
下列描述中隐含化学变化的是( )
| A、水结成冰 |
| B、食盐溶于水 |
| C、燃放鞭炮 |
| D、将块状石灰石研磨成粉末 |
欲除去铁粉中混有的少量铝粉,应选用的试剂是( )
| A、稀盐酸 | B、稀硝酸 |
| C、硫酸铜溶液 | D、氢氧化钠溶液 |
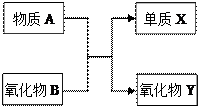 A、B、X、Y均为中学阶段的常见物质,它们之间的转化关系如图所示,试写出符合下列条件的化学方程式:
A、B、X、Y均为中学阶段的常见物质,它们之间的转化关系如图所示,试写出符合下列条件的化学方程式: