题目内容
实验室用H2还原氧化铜,欲得到12.8g铜,则:
(1)至少需要标准状况下的氢气体积多少升?
(2)这些氢气若用电解水的方法来制取,则至少需要电解水多少克?
(1)至少需要标准状况下的氢气体积多少升?
(2)这些氢气若用电解水的方法来制取,则至少需要电解水多少克?
考点:化学方程式的有关计算,电解原理
专题:计算题
分析:(1)发生反应:H2+CuO
Cu+H2O,根据n=
计算Cu的物质的量,根据方程式计算需要氢气的物质的量,再根据V=nVm计算氢气的体积;
(2)电解水发生反应:2H2O
2H2↑+O2↑,根据方程式计算水的物质的量,再根据m=nM计算水的质量.
| ||
| m |
| M |
(2)电解水发生反应:2H2O
| ||
解答:
解:(1)12.8g Cu的物质的量=
=0.2mol,
H2+CuO
Cu+H2O
1 1
n(H2) 0.2mol
n(H2)=
=0.2mol
标况下,需要氢气最少体积=0.2mol×22.4L/mol=4.48L
答:需要氢气的最少体积为4.48L;
(2)设需要水的物质的量为x,则:
2H2O
2H2↑+O2↑
2 2
x 0.2mol
x=
=0.2mol
故需要水的质量=0.2mol×18g/mol=3.6g,
答:需要电解水的质量为3.6g.
| 12.8g |
| 64g/mol |
H2+CuO
| ||
1 1
n(H2) 0.2mol
n(H2)=
| 0.2mol×1 |
| 1 |
标况下,需要氢气最少体积=0.2mol×22.4L/mol=4.48L
答:需要氢气的最少体积为4.48L;
(2)设需要水的物质的量为x,则:
2H2O
| ||
2 2
x 0.2mol
x=
| 0.2mol×2 |
| 2 |
故需要水的质量=0.2mol×18g/mol=3.6g,
答:需要电解水的质量为3.6g.
点评:本题考查化学方程式的有关计算,题目基础性强,侧重对基础知识的巩固.

练习册系列答案
相关题目
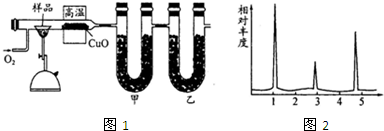


 为确认HCl、H2CO3、H2SiO3的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质).请据此回答:
为确认HCl、H2CO3、H2SiO3的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质).请据此回答: