题目内容
19.在氧化还原反应15CuSO4+11P+24H2O=5Cu3P+6H3PO4+15H2SO4中,1mol CuSO4能氧化磷单质的物质的量是$\frac{1}{5}$mol.分析 首先分析反应中各元素的化合价变化,Cu的价态由+2→+1(还原),11molP元素中6mol化合价升高(氧化)、5mol化合价降低(还原),可见被氧化的6molP,是被Cu(+2)和另一部分P共同氧化的.再分析电子得失数目发现,6mol被氧化的P共失电子30mol,其中Cu(+2)得15mol,另一部分P得另15mol.即15molCuSO4所氧化的P为3mol,则1molCuSO4氧化P$\frac{1}{5}$mol.
解答 解:首先分析反应中各元素的化合价变化,Cu的价态由+2→+1(还原),11molP元素中6mol化合价升高(氧化)、5mol化合价降低(还原),可见被氧化的6molP,是被Cu(+2)和另一部分P共同氧化的.由电子得失数目可知,6mol被氧化的P共失电子6mol×5=30mol,其中Cu(+2)得15mol,另一部分P得另15mol.即15molCuSO4所氧化的P为$\frac{15mol}{5}$=3mol,则1molCuSO4氧化P$\frac{1}{5}$mol.
故答案为:$\frac{1}{5}$mol.
点评 本题考查氧化还原反应基本概念与计算,难度中等,关键根据化合价判断氧化剂与还原剂,可以直接利用Cu(+2)得电子等于CuSO4氧化的磷得电子数守恒计算,更为简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.在80g密度为d g•cm-3的硫酸铁溶液中,含有2.8g Fe3+,则此溶液中SO42-的物质的量浓度为( )
| A. | 0.9375d | B. | 0.9685d | C. | 1.0655d | D. | 0.9135d |
14.某溶液中加入氯化钡溶液生成白色沉淀,再加入稀硝酸沉淀不溶解也无气体逸出,则这种溶液中( )
| A. | 一定含有SO42- | B. | 一定含有Ag+ | ||
| C. | 可能不含CO32- | D. | 可能含有SO42-或Ag+ |
4. 把一块镁铝合金投入到1mol/L HCl溶液里,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中错误的是( )
把一块镁铝合金投入到1mol/L HCl溶液里,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中错误的是( )
 把一块镁铝合金投入到1mol/L HCl溶液里,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中错误的是( )
把一块镁铝合金投入到1mol/L HCl溶液里,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中错误的是( )| A. | HCl溶液的体积为80mL | B. | a的取值范围为0≤a<50 | ||
| C. | 当a值为30时,b值为0.01 | D. | $\frac{n(Mg)}{n(Al)}$的最大值为2.5 |
11.下列叙述正确的是( )
| A. | 当振荡分液漏斗中的混合溶液时,须用一只手压住分液漏斗的玻璃塞,另一只手握住旋塞,将分液漏斗倒转过来,用力振荡 | |
| B. | 检验氨气的方法是将湿润的蓝色石蕊试纸靠近瓶口或管口,观察试纸是否呈红色 | |
| C. | 向FeCl3溶液中滴加几滴KI溶液,振荡静置后分成两份,向其中一份溶液中加入淀粉,溶液呈蓝色;向另一份溶液中滴加KSCN溶液,溶液呈血红色.该实验说明FeCl3与KI反应有一定的限度 | |
| D. | 铁钉放试管中,加入2mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,不久铁钉周围出现蓝色溶液 |
8.下列叙述正确的是( )
| A. | 化学是一门“中心的、实用的、创造性的”科学,在能源、资源的合理开发和安全应用方面有重要的作用 | |
| B. | 胶体与其它分散系的本质区别是胶体有丁达尔效应,而其它分散系却没有 | |
| C. | 借助仪器来分析化学物质的组成是常用的手段,原子吸收光谱常用来确定物质中含有哪些非金属元素 | |
| D. | 提出原子结构模型的科学家按时间先后依次是:道尔顿、卢瑟福、汤姆生、玻尔 |
9.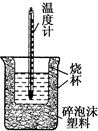 50mL 0.5mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.5mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)从实验装置上看,图中尚缺少一种玻璃仪器是环形玻璃搅拌棒.
(2)大烧杯上如不盖硬纸板,测得的中和热偏大(填“偏大”或“偏小”或“无影响”).
(3)实验中改用60mL 0.50mol•L-1盐酸跟50mL 0.50mol•L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“偏大”或“相等”或“偏小”),所求中和热相等(填“相等”或“不相等”),简述理由:因中和热是指稀强酸与稀强碱发生中和反应生成1molH2O放出的热量,与酸碱的用量无关.
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会偏小;用50mL 0.5mol•L-1盐酸与50mL 0.50mol•L-1 NaOH溶液进行中和测定,测得的中和热数值会无影响.(填“偏大”、“偏小”或“无影响”)
(5)取50mL 0.50mol/L NaOH溶液和30mL0.50mol/L硫酸溶液进行实验,实验数据如下表.
则中和热△H=-53.8kJ/mol(取小数点后一位).
(本题中NaOH溶液和硫酸溶液的密度均取1g/mL,溶液的比热容均取4.2J/(g.℃))
 50mL 0.5mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.5mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少一种玻璃仪器是环形玻璃搅拌棒.
(2)大烧杯上如不盖硬纸板,测得的中和热偏大(填“偏大”或“偏小”或“无影响”).
(3)实验中改用60mL 0.50mol•L-1盐酸跟50mL 0.50mol•L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“偏大”或“相等”或“偏小”),所求中和热相等(填“相等”或“不相等”),简述理由:因中和热是指稀强酸与稀强碱发生中和反应生成1molH2O放出的热量,与酸碱的用量无关.
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会偏小;用50mL 0.5mol•L-1盐酸与50mL 0.50mol•L-1 NaOH溶液进行中和测定,测得的中和热数值会无影响.(填“偏大”、“偏小”或“无影响”)
(5)取50mL 0.50mol/L NaOH溶液和30mL0.50mol/L硫酸溶液进行实验,实验数据如下表.
| 温度 实验次数 | 起始温度T1/℃ | 终止温度T2/℃ | 温度差平均值(T2-T1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 30.1 | ||
| 2 | 27.0 | 27.4 | 33.3 | ||
| 3 | 25.9 | 25.9 | 29.8 | ||
| 4 | 26.4 | 26.2 | 30.4 | ||
(本题中NaOH溶液和硫酸溶液的密度均取1g/mL,溶液的比热容均取4.2J/(g.℃))