题目内容
2.向H2S溶液中加入下列物质:①SO2,②Cl2,③O2,④CuSO4,一定能使溶液酸性增强的是( )| A. | ①③ | B. | ①②④ | C. | ②③④ | D. | ②④ |
分析 H2S具有还原性,能被强氧化剂氧化,H2S属于酸,其水溶液呈酸性,能和硫酸铜反应生成难溶于稀硫酸的CuS,据此分析解答.
解答 解:H2S具有还原性,能被强氧化剂氧化,
①2H2S+SO2=3S↓+2H2O,溶液由酸性变为中性,则溶液中c(H+)减小,故错误;
②H2S+Cl2=S↓+2HCl,氢硫酸属于弱酸、HCl属于强酸,所以溶液酸性增强,故正确;
③2H2S+O2=S↓+2H2O,该反应由酸性变为中性,所以c(H+)减小,故错误;
④H2S+CuSO4=CuS↓+H2SO4,氢硫酸是弱酸、硫酸是强酸,则溶液酸性增强,故正确;
故选D.
点评 本题考查了氢硫酸的性质,根据物质之间的反应分析解答,会正确书写方程式,注意④是中学阶段学习的唯一由弱酸制取强酸的反应,为易错点,题目难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案
相关题目
10.浓HNO3跟下列物质反应,既表现出氧化性又表现出酸性的是( )
| A. | CuO | B. | FeO | C. | C | D. | CaCO3 |
17.用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速度加大的是( )
| A. | 加热 | B. | 不能稀硫酸而用浓硫酸 | ||
| C. | 往溶液中加入少量CuSO4固体 | D. | 不能铁片而用铁粉 |
1.下列各组离子在溶液中大量共存,且加入(NH4)2Fe(SO4)2•6H2O晶体后仍能大量存在的是( )
| A. | Na+、H+、Cl-、NO3- | B. | Na+、Mg2+、Cl-、SO42- | ||
| C. | K+、Ba2+、OH-、I- | D. | Cu2+、H+、Br-、ClO- |
5.检验氯化氢气体中是否混有Cl2,不能采用的方法是( )
| A. | 用湿润的蓝色石蕊试纸 | B. | 用湿润的有色布条 | ||
| C. | 将气体通入AgNO3溶液 | D. | 用湿润的淀粉碘化钾试纸 |
6.下列说法不正确的是( )
| A. | 氕、氘氚是具有相同质子数,不同中子数的三种核素 | |
| B. | CH3CH(CH3)2的名称叫2-甲基丁烷 | |
| C. | CH3CH2NO2和H2NCH2COOH互为同分异构体 | |
| D. | 金刚石和石墨互为同素异形体 |
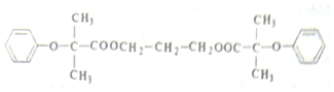
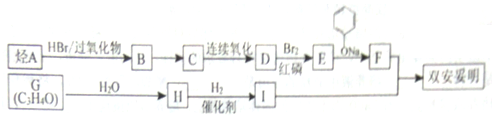
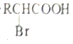 $\stackrel{苯酚钠}{→}$
$\stackrel{苯酚钠}{→}$
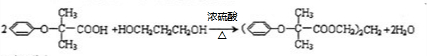 .
.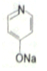 (
( 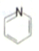 与苯环性质相似)与
与苯环性质相似)与  合成
合成 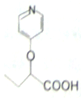 的路线:
的路线: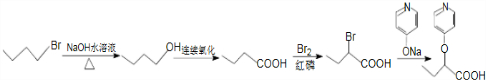 .
. 氧化锌、硫化锌都是重要的基础化工原料.
氧化锌、硫化锌都是重要的基础化工原料.