题目内容
11.相同物质的量的SO2和SO3,氧原子个数比为2:3 质量比为4:5 在标准状况下体积比为1:1硫原子的物质的量比为1:1.分析 根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$结合分子的构成和物质的组成来计算.分子数目之比等于物质的量之比,质量比等于相对分子质量之比,体积比等于物质的量之比,密度之比为相对分子质量之比.
解答 解:由n=$\frac{N}{{N}_{A}}$可知:N=n×NA,物质的量相同的SO2和SO3,氧原子个数比为2:3;
根据m=n×M可知:物质的量相同,质量比等于相对分子质量之比,为64:80=4:5,
在标准状况下的体积比为物质的量之比为1:1;
硫原子的物质的量比为1:1,
故答案为:2:3;4:5;1:1;1:1.
点评 本题考查物质的量的相关计算,题目难度不大,注意有关计算公式的运用,比较容易.

练习册系列答案
相关题目
9.下列实验设计方案错误的是( )
| A. | 除去Cu(NO3)2溶液中混有的AgNO3:加入适量铜粉 | |
| B. | 分离溴和CCl4的混合物:分液 | |
| C. | 区分NaCl和KCl溶液:焰色反应 | |
| D. | 检验某未知溶液中的SO42-:加入稀硝酸酸化的BaCl2溶液 |
2.NA为阿伏加德罗常数的值.下列有关叙述正确的是( )
| A. | 0.1molC2H6O分子中含有C-H键数为0.5NA | |
| B. | 0.1molCl2和0.1molHI充分反应后气体分子数为0.2NA | |
| C. | CO2通过Na2O2使其增重2.8g,反应中转移电子数为0.2NA | |
| D. | 3.Og甲醛(HCHO)和乙酸的混合物中含有的原子总数为0.4NA |
19.在含有下列离子组的溶液中,加入Fe(NO3)2固体后,仍然能够大量共存的离子组是( )
| A. | K+、SO42-、NH4+、CO32- | B. | K+、Ba2+、OH-、Cl- | ||
| C. | Na+、H+、Cl-、SO42- | D. | Na+、Mg2+、Cl-、NO3- |
16.下列各组离子,在水溶液中能大量共存的是( )
| A. | K+、Ag+、NO3-、Cl- | B. | NH4+、Ba2+、Cl-、CO32- | ||
| C. | H+、Ca2+、CO32-、NO3- | D. | Na+、Al3+、SO42-、NO3- |
3.下列制定微粒的数目相等的是( )
| A. | 等物质的量的水与重水含有的中子数 | |
| B. | 等质量的乙烯和丙烯中含有的共用电子对数 | |
| C. | 同温同压同体积的CO和NO含有的质子数 | |
| D. | 等物质的量的镁和铝分别于足量氯气完全反应时转移的电子数 |
1.下列图示与对应的叙述相符的是( )
| A. | 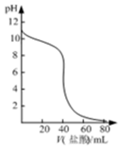 表示常温下盐酸滴加到0.1mol/L某强碱溶液得到的滴定曲线 | |
| B. | 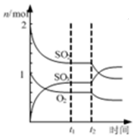 表示一定条件下进行的反应2SO2+O2?2SO3各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 | |
| C. | 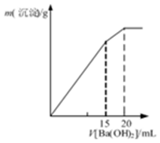 表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mlBa(OH)2溶液时铝离子恰好沉淀完全 | |
| D. | 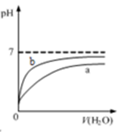 表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是盐酸 |
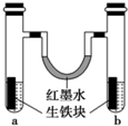 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一.
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一.