题目内容
1.下列叙述中正确的是( )| A. | 在稀溶液中1mol酸和1mol碱完全反应所放出的热量,叫做中和热 | |
| B. | 在101kP时1mol物质燃烧时所放出的热量叫做该物质的燃烧热 | |
| C. | 热化学方程式中,各物质前的化学计量数不表示分子个数 | |
| D. | 在相同条件下,1 molH20(l)完全分解吸收的热量与H2、O2化合生成1 molH2O(g)放出的热量数值相等 |
分析 A.根据中和热是强酸与强碱的稀溶液发生中和反应生成1mol水时放出的热量分析;
B.根据1mol纯净物完全燃烧生成稳定的氧化物放出的热量分析;
C.热化学方程式中的化学计量数只表示物质的量,不表示微粒数,所以系数可以用分数表示.
D.根据液态水转变成气态水要吸热分析.
解答 解:A.中和热是强酸与强碱的稀溶液发生中和反应生成1mol水时放出的热量,故A错误
B.燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,故B错误;
C.热化学方程式中,各物质前的化学计量数不表示分子个数,只表示物质的量,故C正确;
D.因为液态水转变成气态水要吸热,所以1 molH20(l)完全分解吸收的热量与H2、O2化合生成1 molH2O(g)放出的热量数值不相等,故D错误;
故选:C.
点评 本题主要考查了燃烧热、中和热以及热化学方程式等,难度不大,注意概念的掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列说法正确的是( )
| A. | 在测定溶液的pH时,先用蒸馏水湿润,后用玻璃棒醮取溶液点在试纸中部,再与标准比色卡比较 | |
| B. | 某溶液加BaCl2溶液生成白色沉淀,说明原溶液中有SO42- | |
| C. | 提纯含有少量Ba(NO3)2杂质的KNO3溶液,可以使用的方法为加入过量的K2CO3溶液,过滤除去沉淀,所得溶液中补加适量HNO3 | |
| D. | 实验过程中用不完的钠和白磷应直接扔到废液缸中 |
9.下列离子方程式中书写正确的是( )
| A. | 硫酸镁溶液与氢氧化钡溶液反应:Mg2++2OH-═Mg(OH)2↓ | |
| B. | 碳酸钙和稀盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 铜和硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| D. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
13.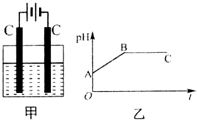 甲装置中所含的是物质的量之比为1:2的CuSO4和NaCl的混合溶液,电解过程中溶液的pH值随时间t变化的示意图如乙示(不考虑电解产物可能与水的反应).试分析下列叙述中正确的是( )
甲装置中所含的是物质的量之比为1:2的CuSO4和NaCl的混合溶液,电解过程中溶液的pH值随时间t变化的示意图如乙示(不考虑电解产物可能与水的反应).试分析下列叙述中正确的是( )
 甲装置中所含的是物质的量之比为1:2的CuSO4和NaCl的混合溶液,电解过程中溶液的pH值随时间t变化的示意图如乙示(不考虑电解产物可能与水的反应).试分析下列叙述中正确的是( )
甲装置中所含的是物质的量之比为1:2的CuSO4和NaCl的混合溶液,电解过程中溶液的pH值随时间t变化的示意图如乙示(不考虑电解产物可能与水的反应).试分析下列叙述中正确的是( )| A. | 是该混合溶液中的SO42-导致了A点溶液的pH值小于B点 | |
| B. | BC段阴极产物和阳极产物的体积之比为2:1 | |
| C. | AB线段与BC线段在阴极上发生的反应是相同的即:Cu2++2e-→Cu | |
| D. | 在整个电解的过程中会出现少量淡蓝色的Cu(OH)2沉淀 |
10.将金属钠分别投入下列物质的稀溶液中,有气体放出,且有白色沉淀生成的是( )
| A. | H2SO4 | B. | NaOH | C. | CuCl2 | D. | MgSO4 |
 实验室可以用二氧化锰和浓盐酸在加热条件下制备氯气.下图为
实验室可以用二氧化锰和浓盐酸在加热条件下制备氯气.下图为