题目内容
下列说法正确的是( )
| A、Na久置空气中,可以和空气中有关物质发生反应,最终生成NaHCO3 |
| B、某溶液中加入BaCl2溶液和足量稀HCl后,仍有白色沉淀,则原溶液中一定有-2价硫酸根 |
| C、相同条件下,实验测得NH4HCO3溶液显碱性,CH3COONH4溶液显中性,说明酸性CH3COOH>H2CO3 |
| D、N2的化学性质通常非常稳定,但在放电条件下可以与O2反应生成NO2 |
考点:钠的化学性质,弱电解质在水溶液中的电离平衡,氮气的化学性质,常见阴离子的检验
专题:基本概念与基本理论,元素及其化合物
分析:A.钠最终生成碳酸钠;
B.能和氯化钡溶液生成白色沉淀且不溶于稀盐酸的离子有银离子、硫酸根离子;
C.CH3COONH4溶液显中性,说明醋酸和一水合氨的电离程度相等,NH4HCO3溶液显碱性说明一水合氨的电离程度大于碳酸;
D.放电条件下,氮气和氧气反应生成NO.
B.能和氯化钡溶液生成白色沉淀且不溶于稀盐酸的离子有银离子、硫酸根离子;
C.CH3COONH4溶液显中性,说明醋酸和一水合氨的电离程度相等,NH4HCO3溶液显碱性说明一水合氨的电离程度大于碳酸;
D.放电条件下,氮气和氧气反应生成NO.
解答:
解:A.切开金属钠置于空气中,切口开始呈银白色(钠的真面目)→变暗(生成Na2O)→变白色固体(生成NaOH)→成液(NaOH潮解)→结块(吸收CO2成Na2CO3?10H2O)→最后变成Na2CO3粉(风化),故A错误;
B.能和氯化钡溶液生成白色沉淀且不溶于稀盐酸的离子有银离子、硫酸根离子,所以原溶液中可能含有硫酸根离子或银离子,故B错误;
C.CH3COONH4溶液显中性,说明醋酸和一水合氨的电离程度相等,NH4HCO3溶液显碱性说明一水合氨的电离程度大于碳酸,所以可以说明酸性CH3COOH>H2CO3,故C正确;
D.放电条件下,N2+O2
2NO,NO不稳定,易被氧气氧化生成二氧化氮,故D错误;
故选C.
B.能和氯化钡溶液生成白色沉淀且不溶于稀盐酸的离子有银离子、硫酸根离子,所以原溶液中可能含有硫酸根离子或银离子,故B错误;
C.CH3COONH4溶液显中性,说明醋酸和一水合氨的电离程度相等,NH4HCO3溶液显碱性说明一水合氨的电离程度大于碳酸,所以可以说明酸性CH3COOH>H2CO3,故C正确;
D.放电条件下,N2+O2
| ||
故选C.
点评:本题考查了物质间的反应,明确物质的性质是解本题关键,熟悉常见物质的性质,易错选项是B,注意:假设加入的酸是硝酸,则原溶液中可能含有亚硫酸根离子.

练习册系列答案
相关题目
有人从市场上购得一瓶“纯净水”,喝过之后感觉有点苦涩味,怀疑是用深层地下水冒充的伪劣产品.已知地下水含Ca2+,Mg2+等离子,家庭中的下列物品可用于检验这两种离子的是( )
| A、纯碱 | B、食盐 | C、食醋 | D、食糖 |
恒温恒容条件下,下列叙述中不是可逆反应2A(g)+3B(s)?2C(g)达到平衡的标志的是( )
①C的生成速率与C的分解速率相等;
②单位时间生成amol A,同时消耗1.5amol B;
③各组分的浓度不再变化;
④混合气体的密度不再变化;
⑤混合气体的总压强不再变化;
⑥混合气体的物质的量不再变化;
⑦混合气体的平均摩尔质量不再变化;
⑧A、B、C的分子数目比为2:3:2.
①C的生成速率与C的分解速率相等;
②单位时间生成amol A,同时消耗1.5amol B;
③各组分的浓度不再变化;
④混合气体的密度不再变化;
⑤混合气体的总压强不再变化;
⑥混合气体的物质的量不再变化;
⑦混合气体的平均摩尔质量不再变化;
⑧A、B、C的分子数目比为2:3:2.
| A、⑤⑥⑧ | B、②⑤⑧ |
| C、①③④ | D、②④⑦ |
向FeSO4的溶液中投入一小块金属钠,反应完全后,滤出沉淀并洗涤之,然后在空气中灼烧沉淀,最终得到的固体物质是( )
| A、Fe2O3 |
| B、FeO |
| C、Fe(OH)3 |
| D、Fe2O3 和Fe3O4 |
在KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O的反应中,还原剂与氧化剂的物质的量之比为( )
| A、1:6 | B、6:1 |
| C、5:1 | D、1:5 |
限用硝酸、硫酸、盐酸、醋酸、钠盐、钾盐、钡盐在溶液中反应,符合离子方程式:2H++CO32-═H2O+CO2↑的化学方程式个数有( )
| A、3个 | B、5个 |
| C、10个 | D、12个 |
用NA表示表示阿伏伽德罗常数的值,下列说法正确的是( )
| A、常温下,6.4g S6与S8的混合物中所含S原子数为0.2NA |
| B、1L 1mol/L FeCl3溶液中Cl-数为NA |
| C、标况下,2.24LH2O所含原子数为0.3NA |
| D、22g二氧化碳与标况下11.2L HCl含有的分子数均为0.5NA |
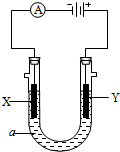 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: