题目内容
19.现有①Ar②金刚石 ③NH4Cl ④SiO2⑤干冰 ⑥K2S ⑦N2七种物质,按下列要求回答:(填序号)(1)属于离子化合物的是③⑥,熔化时需要破坏共价键的是②④.
(2)⑤的电子式是
 ,⑦的电子式是
,⑦的电子式是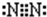 .
.
分析 (1)一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键;
(2)二氧化碳分子中每个氧原子和碳原子形成 两对共用电子对,氮气分子中两个N原子形成三对共用电子对.
解答 解:(1)一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,氯化铵是由铵根离子和氯离子构成的离子化合物,硫化钾是由钾离子和硫离子构成的离子化合物,所以属于离子化合物的是③⑥;
金刚石和二氧化硅为原子晶体熔化时破坏共价键,则熔化时需要破坏共价键的是②④;
故答案为:③⑥;②④;
(2)干冰为分子晶体,含有共价键,电子式为 ;氮气分子中两个N原子形成三对共用电子对,氮气分子的电子式为
;氮气分子中两个N原子形成三对共用电子对,氮气分子的电子式为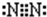 ,
,
故答案为: ;
;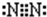 .
.
点评 本题考查了离子化合物的判断和电子式的书写等知识点,根据物质的构成微粒确定化合物类型,再结合电子式及结构式书写特点书写,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.稀土硼化物广泛用于雷达、航空航天、冶金、环保等多个高科技领域.下列元素与硼元素处于同一主族的是( )
| A. | Be | B. | O | C. | Mg | D. | Al |
7.下列有关铝的叙述中不正确的是( )
| A. | 铝合金的强度和硬度都比纯铝的大 | |
| B. | 铝制的容器可以贮存浓硫酸或浓硝酸 | |
| C. | 铝表面的氧化膜可用盐酸或氢氧化钠溶液除去 | |
| D. | 将金属钠加入到氯化铝溶液中可制得铝 |
14.下面说法正确的是( )
| A. | 含有羟基的化合物一定属于醇类 | |
| B. | 酚和醇都含有羟基,但其化学性质不完全相同 | |
| C. | 分子中含有苯环和羟基的化合物一定是酚 | |
| D. | Na2SO3、Na2O2、苯酚久置于空气中,颜色均有变化 |
4.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 2gH2所含的原子数目为NA | |
| B. | 标准状况下,22.4L水中含有水分子数为NA | |
| C. | 常温下,1L0.1mol•L-1的MgCl2溶液中含有的Cl-数为0.2NA | |
| D. | 常温常压下,11.2L CH4中含有的氢原子数为2NA |
11.下列叙述中,可以肯定金属A比金属B的活动性强的是( )
| A. | A原子最外层电子数比B原子最外层电子数少 | |
| B. | A的最高价氧化物对应水化物的碱性强于B的最高价氧化物对应水化物的碱性 | |
| C. | 1molA与足量酸反应生成的H2比1molB与足量酸反应生成的H2多 | |
| D. | 常温时,A、B均能导电,且导电性良好 |
13.有下列两组命题:
B组中命题正确,但不能用A组命题进行解释的是( )
| A组 | B组 |
| Ⅰ.H-F键的键能大于H-O键的键能 | ①HF的沸点比H2O低 |
| Ⅱ.H-H…F氢键的键能大于O-H…O氢键的键能 | ②HF比H2O稳定 |
| Ⅲ.HF分子间能形成的氢键个数比H2O分子少 | ③HF的沸点比H2O高 |
| Ⅳ.HF分子与水分子可形成氢键 | ④HF极易溶于水 |
| A. | I② | B. | Ⅱ③ | C. | Ⅲ① | D. | Ⅲ④ |

 ,等物质的量的A、D完全燃烧生成水的质量之比为5:4;
,等物质的量的A、D完全燃烧生成水的质量之比为5:4; +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$ +NaCl+H2O;
+NaCl+H2O; .
. 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的 一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的 一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题: ,反应类型加聚反应.
,反应类型加聚反应.